题目内容
下列推论正确的是( )
| A.S(g)+O2(g)=SO2(g)△H1,S(s)+O2(g)=SO2(g)△H2; 则:△H1>△H2 |
| B.C(石墨,s)=C(金刚石,s)△H=+1.9kJ/mol,则:由石墨制取金刚石的反应是吸热反应,金刚石比石墨稳定 |
| C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.4kJ/mol,则:含20gNaOH的溶液与稀盐酸完全反应,放出的热量为28.7kJ |
| D.CaCO3(s)=CaO(s)+CO2(g)△H>0,△S>0,则:该反应任何温度下都能自发进行 |
C
A、从固态到气态是吸热过程,两个反应均为放热反应,故第一个反应放出的热量更多。故:△H1<△H2;
B、能量越低越稳定,故石墨能量更低,更稳定。
C、1mol反应放出57.4KJ的热量,故0.5mol放出28.7KJ;
D、该反应在高温下可以自发进行。
B、能量越低越稳定,故石墨能量更低,更稳定。
C、1mol反应放出57.4KJ的热量,故0.5mol放出28.7KJ;
D、该反应在高温下可以自发进行。

练习册系列答案
相关题目
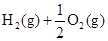 ══
══

 ══
══

 ══2CO2(g)+2H2O(l)
══2CO2(g)+2H2O(l)
 ══
══



 2SO3 (g) △H =-196.6kJ·mol-1
2SO3 (g) △H =-196.6kJ·mol-1
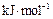
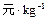
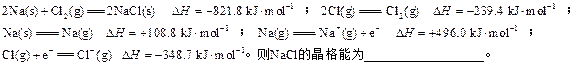
 稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是( )
稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是( ) )+
)+ H2 SO4(aq)=K2SO4(aq)+H2O(l);ΔH=-57.3kJ/mol
H2 SO4(aq)=K2SO4(aq)+H2O(l);ΔH=-57.3kJ/mol