题目内容
【题目】已知CeO2通常既不溶于强酸,也不溶于强碱。某工厂以平板电视显示屏厂的废玻璃粉末(含CeO2、SiO2、Fe2O3、FeO等物质)为原料,设计如下图所示工艺流程,制得纯净的CeO2。下列说法正确的是( )
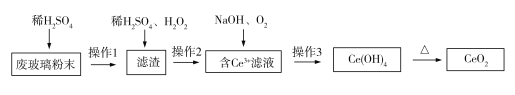
A. 实验室中,操作3和操作1、操作2所用仪器不同
B. 滤渣中加入稀H2SO4和H2O2,其中H2O2做氧化剂
C. 滤液中Ce3+与NaOH、O2的反应属于化合反应
D. 操作2分离得到的滤渣中一定含有未反应的SiO2
【答案】D
【解析】
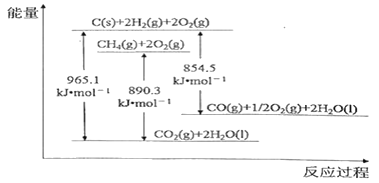
由流程图可知,向玻璃粉末中加入稀硫酸,Fe2O3和FeO溶解,CeO2和SiO2不溶解,过滤得到的滤渣中含有CeO2和SiO2;向滤渣中加入稀H2SO4和H2O2,CeO2做氧化剂,被H2O2还原为Ce3+,过滤得到含Ce3+的滤液和含有SiO2的滤渣;滤液中Ce3+与NaOH、O2反应生成Ce(OH)4沉淀,过滤得到Ce(OH)4固体和硫酸钠溶液;Ce(OH)4固体加热分解得到CeO2。
根据上述分析可知,
A. 操作1、操作2和操作3都是过滤,所用仪器完全相同,A项错误;
B. CeO2与稀H2SO4和H2O2反应时,CeO2作氧化剂,H2O2作还原剂,B项错误;
C.Ce3+与NaOH、O2反应生成Ce(OH)4沉淀时,Ce3+作还原剂,O2作氧化剂,反应的离子方程式为:2Ce2(SO4)3+O2+12NaOH+2H2O![]() 4Ce(OH)4↓+6Na2SO4,该反应不属于化合反应,C项错误;
4Ce(OH)4↓+6Na2SO4,该反应不属于化合反应,C项错误;
D. SiO2是酸性氧化物,不与稀H2SO4反应,操作2分离得到的滤渣中主要成分是SiO2,D项正确;
答案选D。

【题目】短周期元素W、X 、Y 和Z 在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。回答下列问题:
W | X | |||
Y | Z |
(1) X在元素周期表中的位置为_______;画出X的简单离子结构示意图_______。
已知X元素的一种原子,其中子数为10,写出这种原子的原子符号_____________。
(2)四种元素简单离子的半径由大到小为_____________(用离子符号表达)。
(3)W、X的最简单氢化物稳定性为_______>________(填化学式)。
(4)Z最高价氧化物的水化物与Y最高价氧化物对应水化物反应的化学方程式为______ 。
(5)ZX2气体是一种广谱杀菌消毒剂。工业上可利用NaZX3和NaZ 在酸性条件下制得ZX2 同时得到Z元素的单质,该反应的离子方程式为_____________。
【题目】实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4+6HCHO===3H++6H2O+(CH2)6N4H+[滴定时,1 mol(CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸.某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ 称取样品1.500 g。
步骤Ⅱ 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积________(填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察____________________。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由______色变成____________色。
(2)滴定结果如下表所示:
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.20 | 20.20 |
若NaOH标准溶液的浓度为0.1010 mol/L,则该样品中氮的质量分数为________。