题目内容
【题目】下表是元素周期表的一部分。

回答下列问题:
(1)元素b在元素周期表中的位置是________。
(2)元素e的负一价离子的结构示意图为________,与元素g的简单离子,二者的离子半径大小顺序为________。(用离子符号表示)
(3)元素i的气态氢化物比元素e的气态氢化物________(填“稳定”或“不稳定”)。
(4)元素i的单质溶于元素f的最高价氧化物对应的水化物中,可生成具有漂白作用的一种盐,该盐的电子式为______________。
【答案】 第二周期第ⅣA族 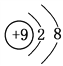 F->Al3+ 不稳定
F->Al3+ 不稳定 ![]()
【解析】由元素在周期表中位置可知:a为H元素、b为C元素、c为N元素、d为O元素、e为F元素、f为Na元素、g为Al元素、h为S元素、i为Cl元素。
(1)b为C元素,处于周期表中第二周期第ⅣA族。
(2)e为F元素,其负一价离子为F-,原子核内9个质子,核外10个电子,故F-的结构示意图为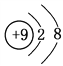 ;g为Al元素,其简单离子为Al3+,F-、Al3+电子层结构相同,核电荷数越大离子半径越小,故离子半径:F->Al3+。
;g为Al元素,其简单离子为Al3+,F-、Al3+电子层结构相同,核电荷数越大离子半径越小,故离子半径:F->Al3+。
(3)i为Cl元素,e为F元素,非金属性Cl<F,元素非金属性越强,其氢化物越稳定,故HCl比HF不稳定。
(4)i为Cl元素,f为Na元素,Cl2与NaOH反应生成具有漂白作用的一种盐为NaClO,NaClO由钠离子与次氯酸根离子构成,次氯酸根离子中氧原子与氯原子之间形成1对共用电子,故NaClO电子式为:![]() 。
。

练习册系列答案
相关题目