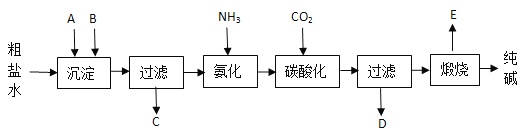
题目内容
【题目】一定质量的乙醇在氧气不足的情况下燃烧,得到CO、CO2和水的总质量为27.6g,若其中水的质量为10.8g,则CO的质量是( )
A.4.4g
B.1.4g
C.2.2g
D.在2.2g和4.4g之间
【答案】B
【解析】解:设乙醇的物质的量为x,由
C2H5OH~ | 3H2O |
1mol | 54g |
x | 10.8g |
![]() ,
,
解得x=0.2mol,
由乙醇的分子式可知n(CO2)+n(CO)=0.2mol×2=0.4mol,
则m(CO2)+m(CO)=27.6g﹣10.8g=16.8g,则平均摩尔质量为 ![]() =42gmol﹣1,
=42gmol﹣1,
由十字交叉法可知: 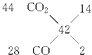 ,
,
所以m(CO)=28gmol﹣1×0.4mol× ![]() =1.4g,
=1.4g,
所以CO的质量为1.4g,
故选B.
根据反应中生成水的质量可确定乙醇的物质的量,进而求出碳原子的物质的量,同时也是CO2和CO的物质的量和,再根据二者总的质量求出平均摩尔质量,最后用十字交叉法解题.

【题目】亚硝酸钠(化学式为 NaNO2)是一种常用的防腐剂,回答下列问题:
(1)NaNO2 中 N 元素的化合价为_________.
(2)亚硝酸钠在 320°C 时能分解产生氧化钠固体、一氧化氮和一种常见的助燃性气体。该反应的化学方程式_________________。
(3)我国规定火腿肠中亚硝酸钠添加标准为每千克食品含量不超过 150 毫克,以此计算,200g 15%的亚硝酸钠溶液至少可用于生产火腿肠______千克。
(4)在酸性条件下,NaNO2与按物质的量 1:1 恰好完全反应,且I-被氧化为 I2时,产物中含氮的物质为________(填化学式)。
(5)工业废水中的 NaNO2 可用铝粉除去,已知此体系中包含 AI、NaAlO2、NaNO2、NaOH、NH3、H2O 六种物质。该反应的化学方程式为____________。
(6)某同学设计实验对工业产品中 NaNO2 的含量进行测定,你取固体样品 2g,完全溶解配制成溶液 100mL 取出 25mL 溶液用 0.100 mol/L 酸性 KMnO4 溶液进行滴定(杂质不与 KMnO4 反应),实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积/mL | 20.70 | 20.02 | 20.00 | 19.98 |
该样品中亚硝酸钠的质量分数为_________.(已知:5NO2-+2MnO4-+6H+ = 5NO3-+2Mn2++3H2O)