题目内容
20. 现有A、B、C、D、E五种元素,前四种短周期元素在周期表中的位置如图所示,D的主要化合价为-2、+6,E2+的质子数比D的质子数多4,下列说法正确的是( )
现有A、B、C、D、E五种元素,前四种短周期元素在周期表中的位置如图所示,D的主要化合价为-2、+6,E2+的质子数比D的质子数多4,下列说法正确的是( )| A. | C可分别与A、E元素形成离子化合物 | |
| B. | D可形成三种价态的酸 | |
| C. | 原子半径:E>D>B>A>C | |
| D. | 最常见气态氢化物的稳定性:C>B>D>A |
分析 A、B、C、D、E五种元素,前四种短周期元素在周期表中的位置如图所示,D的主要化合价为-2、+6,A、B、C为第二周期元素而D为第三周期元素,根据D的主要化合价知,D为S元素,则A、B、C分别是N、O、F元素;E2+的质子数比D的质子数多4,D质子数是16,E质子数是20,则E为Ca元素,
A.非金属元素之间易形成共价化合物;
B.D是S元素,含有S元素的酸有H2S、H2SO3、H2SO4;
C.电子层数越多原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,同主族元素从上到下原子半径逐渐增大;
D.元素的非金属性越强,其氢化物的稳定性越强.
解答 解:A、B、C、D、E五种元素,前四种短周期元素在周期表中的位置如图所示,D的主要化合价为-2、+6,A、B、C为第二周期元素而D为第三周期元素,根据D的主要化合价知,D为S元素,则A、B、C分别是N、O、F元素;E2+的质子数比D的质子数多4,D质子数是16,E质子数是20,则E为Ca元素,
A.非金属元素之间易形成共价化合物,所以A、C之间形成的化合物是共价化合物,故A错误;
B.D是S元素,含有S元素的酸有H2S、H2SO3、H2SO4,所以有三种价态的酸,故B正确;
C.电子层数越多原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,同主族元素从上到下原子半径逐渐增大,所以原子半径:E>D>A>B>C,故C错误;
D.元素的非金属性越强,其氢化物的稳定性越强,非金属性N>S,所以H2S的稳定性比NH3的稳定性弱,故D错误;
故选B.
点评 本题考查元素周期表和元素周期律的综合应用,侧重考查基本概念、元素推断、元素周期律等知识点,正确判断元素是解本题关键,注意元素周期律的灵活运用,易错选项是B.

练习册系列答案
相关题目
10.下列说法中正确的是( )
| A. | CO2、SO2、NO2都能和碱溶液发生反应,因此它们都属于酸性氧化物 | |
| B. | Na2O2晶体中既含有离子键又含有共价键 | |
| C. | Na2O、Fe2O3、Al2O3属于碱性氧化物 | |
| D. | SiO2不能与水反应生成硅酸,所以SiO2不是酸性氧化物 |
11.两个容积相同的容器中,一个盛有CO气体,另一个盛有N2气,在同温同压下,两容器内的气体一定具有相同的:①分子数 ②原子数 ③质量 ④密度 ⑤质子数 ⑥电子数( )
| A. | 只有①② | B. | 只有①②③ | C. | 只有①②③④ | D. | 全部 |
15.下列说法正确的是( )
| A. | 能电离出H+的化合物叫做酸 | |
| B. | 含有金属元素的离子一定都是阳离子 | |
| C. | 金属氧化物不一定能与酸反应生成盐和水 | |
| D. | 由同种元素组成的物质肯定是纯净物 |
9.“促进低碳经济”是世界环境日的主题,《联合国气候变化框架公约》第15次缔约方会议也商讨了2012年至2020年的全球减排协议.下列行为中不符合“促进低碳经济”宗旨的是( )
| A. | 开发太阳能、水能、风能、可燃冰等新能源,减少使用煤、石油等化石燃料 | |
| B. | 将煤进行气化处理,提高煤的综合利用效率 | |
| C. | 研究采煤、采油新技术,提高产量以满足工业生产的快速发展 | |
| D. | 实现资源的“3R”利用观,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、资源的循环再生(Recycle) |
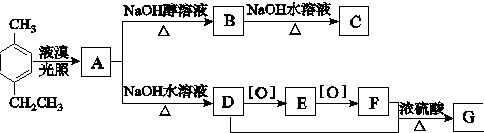
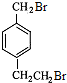 .
.
 .
.