题目内容
10.下列说法中正确的是( )| A. | CO2、SO2、NO2都能和碱溶液发生反应,因此它们都属于酸性氧化物 | |
| B. | Na2O2晶体中既含有离子键又含有共价键 | |
| C. | Na2O、Fe2O3、Al2O3属于碱性氧化物 | |
| D. | SiO2不能与水反应生成硅酸,所以SiO2不是酸性氧化物 |
分析 A、酸性氧化物是指能和碱反应生成盐和水的氧化物;
B、Na2O2晶体中含有钠离子和过氧根离子;
C、碱性氧化物是指能和酸反应生成盐和水的氧化物;
D、酸性氧化物是指能和碱反应生成盐和水的氧化物.
解答 解:A、CO2、SO2都能和碱溶液发生反应,因此它们都属于酸性氧化物,但是NO2不属于酸性氧化物,它和碱反应还会产生NO,故A错误;
B、Na2O2晶体中含有钠离子和过氧根离子,既含有离子键又含有共价键,故B正确;
C、Na2O、Fe2O3属于碱性氧化物,Al2O3属于两性氧化物,故C错误;
D、SiO2不能与水反应生成硅酸,但是能和碱反应生成盐和水,属于酸性氧化物,故D错误.
故选B.
点评 本题考查学生物质的分类知识,注意对酸性氧化物和碱性氧化物的理解是关键,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.某些含羟基的药物具有苦味,如以下结构的氯霉素:此药物分子中碳链末端羟基(-OH)中的氢原子换成来自棕榈酸中的原子团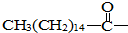 后,苦味消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的是( )
后,苦味消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的是( )
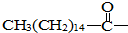 后,苦味消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的是( )
后,苦味消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的是( )| A. | 它是棕榈酸的酯类 | B. | 它是棕榈酸的盐类 | ||
| C. | 它的水溶性变好,所以苦味消失 | D. | 该过程发生了中和反应 |
1.在一定条件下,将N2和H2按体积比1:3混合充入某密闭容器中,发生反应:N2+3H2?2NH3.当反应在平衡时,恢复到原温度和压强下,测得NH3的体积分数为40%,则N2在平衡混合体系中的体积分数为( )
| A. | 15% | B. | 20% | C. | 30% | D. | 40% |
18.下列化工工艺可得到汽油的是( )
| A. | 干馏 | B. | 常压分馏 | C. | 裂解 | D. | 催化重整 |
5.卧室、林荫小道、电影院的空气属于( )
| A. | 化合物 | B. | 单质 | C. | 混合物 | D. | 纯净物 |
15.在恒温下的密闭容器中,有可逆反应N2+3H2?2NH3(该反应放热),不能说明已达到平衡状态的是( )
| A. | 1molN≡N键断裂的同时,有6molN-H键断裂 | |
| B. | 反应器中压强不随时间变化而变化 | |
| C. | v正(NH3)=v逆(H2) | |
| D. | 混合气体平均相对分子质量保持不变 |
19.下列四组溶液分别倒入四只烧杯中,并加蒸馏水稀释至50mL,其中NO${\;}_{3}^{-}$物质的量浓度最大的是( )
| A. | 30 mL 1 mol/L的KNO3溶液 | B. | 20 mL 0.5 mol/L的Ba(NO3)2溶液 | ||
| C. | 10 mL 0.6 mol/L的Mg(NO3)2溶液 | D. | 40 mL 0.3 mol/L的Fe(NO3)3溶液 |
20. 现有A、B、C、D、E五种元素,前四种短周期元素在周期表中的位置如图所示,D的主要化合价为-2、+6,E2+的质子数比D的质子数多4,下列说法正确的是( )
现有A、B、C、D、E五种元素,前四种短周期元素在周期表中的位置如图所示,D的主要化合价为-2、+6,E2+的质子数比D的质子数多4,下列说法正确的是( )
 现有A、B、C、D、E五种元素,前四种短周期元素在周期表中的位置如图所示,D的主要化合价为-2、+6,E2+的质子数比D的质子数多4,下列说法正确的是( )
现有A、B、C、D、E五种元素,前四种短周期元素在周期表中的位置如图所示,D的主要化合价为-2、+6,E2+的质子数比D的质子数多4,下列说法正确的是( )| A. | C可分别与A、E元素形成离子化合物 | |
| B. | D可形成三种价态的酸 | |
| C. | 原子半径:E>D>B>A>C | |
| D. | 最常见气态氢化物的稳定性:C>B>D>A |