题目内容
【题目】Ⅰ、下表是元素周期表的一部分,请回答有关问题:
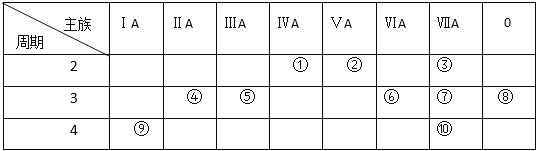
(1)表中能形成两性氢氧化物的元素是 _________ (用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式_____________________________。
(2)④元素与⑦元素形成的化合物的电子式 _____________________________。
(3)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是 ______。(填化学式)
Ⅱ、A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图为: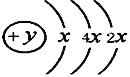 ,B、C可形成离子化合物B3C2,据此填空:
,B、C可形成离子化合物B3C2,据此填空:
(1)A元素在周期表中的位置_____________________________。
(2)A、B、C、D四种元素的原子,半径由小到大的顺序为_______________。
(3)B和C的最高价氧化物对应的水化物反应的离子方程式为______________。
【答案】 Al 2Al+2KOH+2H2O=2KAlO2+3H2 ↑ ![]() HClO4 第三周期第ⅣA族 N<P<Si<Mg Mg(OH)2 + 2H+ = Mg2+ + 2H2O
HClO4 第三周期第ⅣA族 N<P<Si<Mg Mg(OH)2 + 2H+ = Mg2+ + 2H2O
【解析】试题分析:根据元素周期表,元素①②③④⑤⑥⑦⑧⑨⑩分别是C、N、F、Mg、Al、S、Cl、Ar、K、Br。Ⅱ、A的原子结构示意图为:![]() ,x=2,y=14,A是Si元素;A与B同周期,原子序数A>B,B和C可形成离子化合物B3C2,可推知B的化合价为+2,应为镁,C为氮,D和C同主族,均为短周期元素,则D为磷。
,x=2,y=14,A是Si元素;A与B同周期,原子序数A>B,B和C可形成离子化合物B3C2,可推知B的化合价为+2,应为镁,C为氮,D和C同主族,均为短周期元素,则D为磷。
解析:根据以上分析,(1)氢氧化铝是两性氢氧化物,能形成两性氢氧化物的元素是Al,⑨最高价氧化物的水化物是氢氧化钾,铝与氢氧化钾溶液反应生成偏铝酸钾和氢气,化学方程式为2Al+2KOH+2H2O=2KAlO2+3H2 ↑。
(2)镁元素与氯元素形成的化合物是氯化镁,属于离子化合物,氯化镁的电子式 ![]() 。
。
(3)非金属性越强,最高价氧化物的水化物中酸性最强,H2CO3、HNO3、H2SO4、HClO4中 酸性最强的是HClO4。
Ⅱ、(1)Si元素在周期表中的位置第三周期第ⅣA族。
(2)Si、Mg、N、P四种元素的原子,半径由小到大的顺序为N<P<Si<Mg。
(3)氢氧化镁和硝酸反应生成硝酸镁和水,离子方程式为Mg(OH)2 + 2H+ = Mg2+ + 2H2O。

 阅读快车系列答案
阅读快车系列答案