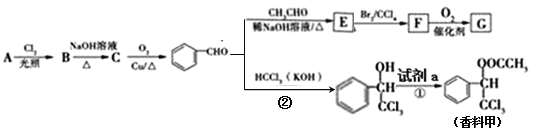
题目内容
【题目】下列关于热化学反应的描述中正确的是( )
A. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则1 mol硫酸与足量氢氧化钡溶液反应放热为 114.6 kJ
B. H2(g)的燃烧热是285.8 kJ·mol-1,则2H2O(l)===2H2(g)+O2(g)反应的ΔH=+571.6 kJ·mol-1、
C. 放热反应比吸热反应容易发生
D. 1 mol丙烷燃烧生成水和二氧化碳所放出的热量是丙烷的燃烧热
【答案】B
【解析】中和热是强酸和强碱稀溶液反应生成![]() 液态水放出的能量,和消耗的酸、碱的物质的量之间没有关系,1 mol硫酸与足量氢氧化钡溶液反应生成2mol液态水,放出的热量为114.6 kJ,同时硫酸根离子和钡离子生成沉淀也放出热量,所以1 mol硫酸与足量氢氧化钡溶液反应放热大于114.6 kJ,A错误;H2(g)的燃烧热是285.8 kJ·mol-1,则2H2(g)+O2(g)=2H2O(l)ΔH=-571.6 kJ·mol-1,所以2H2O(l)===2H2(g)+O2(g)反应的ΔH=+571.6 kJ·mol-1;B正确;氢气与氧气常温下不反应,在点燃条件下发生反应,该反应为放热反应;而氢氧化钡晶体与氯化铵常温下发生反应,该反应为吸热反应;所以放热反应不一定比吸热反应容易发生,C错误;1 mol丙烷燃烧生成液态水和气态二氧化碳时所放出的热量是丙烷的燃烧热,D错误;正确选项B。
液态水放出的能量,和消耗的酸、碱的物质的量之间没有关系,1 mol硫酸与足量氢氧化钡溶液反应生成2mol液态水,放出的热量为114.6 kJ,同时硫酸根离子和钡离子生成沉淀也放出热量,所以1 mol硫酸与足量氢氧化钡溶液反应放热大于114.6 kJ,A错误;H2(g)的燃烧热是285.8 kJ·mol-1,则2H2(g)+O2(g)=2H2O(l)ΔH=-571.6 kJ·mol-1,所以2H2O(l)===2H2(g)+O2(g)反应的ΔH=+571.6 kJ·mol-1;B正确;氢气与氧气常温下不反应,在点燃条件下发生反应,该反应为放热反应;而氢氧化钡晶体与氯化铵常温下发生反应,该反应为吸热反应;所以放热反应不一定比吸热反应容易发生,C错误;1 mol丙烷燃烧生成液态水和气态二氧化碳时所放出的热量是丙烷的燃烧热,D错误;正确选项B。

练习册系列答案
相关题目