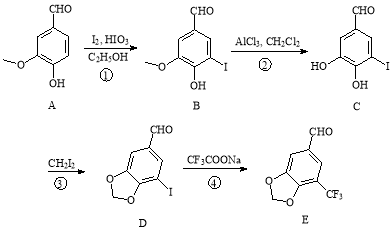
题目内容
【题目】NH3—O2碱性燃料电池的示意图如下,有关说法正确的是
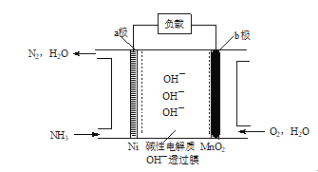
A. a极每产生1molN2,约有6×6.02×1023个OH-迁移至b极
B. a极的电极反应为:2NH3 -6e- = N2+ 6H+
C. b极的电极反应为:4OH- -4e- = 2H2O + O2↑
D. 该电池总反应为:4NH3 + 3O2 = 2N2 + 6H2O
【答案】D
【解析】
燃料电池
A.溶液中阴离子向负极移动,OH-迁移至a极,故A错误;
B. a极通入燃料为负极,负极上是燃料氨气发生失电子的氧化反应,负极反应为2NH3 -6e-+6OH- = N2+ 6H2O,故B错误;
C.b极通入氧气为正极,正极上氧气得电子生成氢氧根离子,正极反应为O2+4e-+2H2O=4OH-,故C错误;
D.燃料电池中负极反应为2NH3 -6e-+6OH- = N2+ 6H2O,正极反应为O2+4e-+2H2O=4OH-,则电池总反应为:4NH3 + 3O2 = 2N2 + 6H2O,故D正确。
故选D。

【题目】氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:
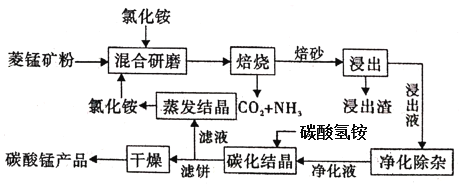
已知:①菱锰矿石主要成分是![]() ,还含有少量Fe、Al、Ca、Mg等元素;
,还含有少量Fe、Al、Ca、Mg等元素;
②相关金属离子![]() 形成氯氧化物沉淀时的pH如下:
形成氯氧化物沉淀时的pH如下:
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
③常温下, ![]() 的溶度积分别为
的溶度积分别为![]()
回答下列问题:
(1)“焙烧”时发生的主要化学反应方程式为_____________________。
(2)分析下列图1、图2、图3,氯化铵焙烧菱镁矿的最佳条件是:

焙烧温度_________,氯化铵与菱镁矿粉的质量之比为__________,焙烧时间为___________.
(3)浸出液“净化除杂”过程如下:首先加入![]() 氧化为
氧化为![]() ,反应的离子方程式为________;然后调节溶液pH使
,反应的离子方程式为________;然后调节溶液pH使![]() 沉淀完全,此时溶液的pH范围为____。再加入
沉淀完全,此时溶液的pH范围为____。再加入![]() 沉淀
沉淀![]() ,当
,当![]() 时,
时, ![]() =______
=______![]()
(4)碳化结晶时,发生反应的离子方程式为___________。
(5)流程中能循环利用的固态物质是____________。