题目内容
按要求完成下列各小题:
(1)我国古代四大发明之一的黑火药,爆炸时的反应为S+2KNO3+3C=K2S+N2↑+3CO2,该反应中还原剂是 ,氧化剂是 。
(2)制普通玻璃的原料是 ,其中 是制水泥和普通玻璃的共同原料。
(3)用氧化物的形式表示某硅酸盐的组成:K4Al4FeSi6O18(OH)7 .
(4)漂白粉的成分是 ,工业制漂白粉的化学方程式为 漂白粉在空气中保存不当会失效的原因,用化学方程式表示
(5)将23gNa与28g硅同时投入水中,理论上放出H2 g,写出反应中有关的离子方程式 。
(1)C S和KNO3 (2)纯碱、石灰石、石英 石灰石
(3)4K2O·4Al2O3·Fe2O3·12SiO2·7H2O
(4)CaCl2和Ca(ClO)2 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
Ca(ClO)2+CO2+H2O=CaCO3+2HClO
(未写出: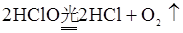 不扣分)
不扣分)
(5)3g 2Na+2H2O=2Na++2OH-+H2 Si+2OH-+H2O=SiO32-+2H2
【解析】

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案(13分)按要求完成下列各小题。
(1)用CO2来生产燃料甲醇的反应原理:CO2(g)+3H2(g) CH3OH(g)+H2O(g),某些化学键的键能数据如下表:
CH3OH(g)+H2O(g),某些化学键的键能数据如下表:
|
化学键 |
C-C |
C-H |
H-H |
C-O |
C=O |
H-O |
|
键能/kJ·mol-1 |
348 |
413 |
436 |
358 |
750 |
463 |
计算反应上述反应的焓变△H=_______________________
写出上述反应的平衡常数表达式K=__________________,若升高温度,则平衡常数K________(填“增大”或“减小”或“不变”)。该反应的△S______0(填“>”或“<”或“=”),在 _________(填“较高”或“较低”)温度下有利于该反应自发进行。
(2)在25℃下,向浓度均为0.01 mol・L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为________________。
(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3×10-34。)
(3)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11。在此温度下,将pH=2的H2SO4溶液VaL与pH=12的NaOH溶液VbL混合,若所得混合液为中性,则Va︰Vb= 。
(4)在25℃时,将cmol·L-1的醋酸溶液与0.02mol·L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=____________________。
 按要求完成下列各小题:
按要求完成下列各小题:

 键的具体类型(即参与成键的原子轨道)
键的具体类型(即参与成键的原子轨道) 