题目内容
(13分)按要求完成下列各小题。
(1)用CO2来生产燃料甲醇的反应原理:CO2(g)+3H2(g) CH3OH(g)+H2O(g),某些化学键的键能数据如下表:
CH3OH(g)+H2O(g),某些化学键的键能数据如下表:
|
化学键 |
C-C |
C-H |
H-H |
C-O |
C=O |
H-O |
|
键能/kJ·mol-1 |
348 |
413 |
436 |
358 |
750 |
463 |
计算反应上述反应的焓变△H=_______________________
写出上述反应的平衡常数表达式K=__________________,若升高温度,则平衡常数K________(填“增大”或“减小”或“不变”)。该反应的△S______0(填“>”或“<”或“=”),在 _________(填“较高”或“较低”)温度下有利于该反应自发进行。
(2)在25℃下,向浓度均为0.01 mol・L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为________________。
(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3×10-34。)
(3)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11。在此温度下,将pH=2的H2SO4溶液VaL与pH=12的NaOH溶液VbL混合,若所得混合液为中性,则Va︰Vb= 。
(4)在25℃时,将cmol·L-1的醋酸溶液与0.02mol·L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=____________________。
(13分)
(1) -178 kJ·mol-1 (2分),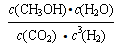 (1分),减小(1分),<(1分),较低(1分)
(1分),减小(1分),<(1分),较低(1分)
(2)Al(OH)3(1分) Al3++3NH3·H2O==Al(OH)3↓+3NH4+ (2分)
(3)10:1 (2分)
(4)2×10—9/(c—0.02) (2分)
【解析】
试题分析:(1)反应热就是断键吸收的能量和形成化学键所放出的能量的差值,所以根据键能可知,该反应的反应热是△H=750kJ/mol×2+436kJ/mol×3-413kJ/mol3-463kJ/mol×3-358kJ/mol=-178kJ/mol;化学常数是在一定条件下的可逆反应中,当可逆反应反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的方程式可知,该反应的平衡常数是K=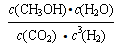 ;正反应是放热反应,升高温度平衡向逆反应方向移动,平衡常数减小;根据方程式可知,正反应是体积减小的,所以△S小于0;根据△G=△H-T·△S可知,要使反应是自发的,则△G必需小于0,所以反应在较低的温度下是自发的。
;正反应是放热反应,升高温度平衡向逆反应方向移动,平衡常数减小;根据方程式可知,正反应是体积减小的,所以△S小于0;根据△G=△H-T·△S可知,要使反应是自发的,则△G必需小于0,所以反应在较低的温度下是自发的。
(2)根据溶度积常数的表达式可知,生成氢氧化镁沉淀时需要的OH-浓度是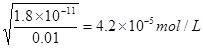 ;同样可知生成氢氧化铝沉淀时需要的OH-浓度是
;同样可知生成氢氧化铝沉淀时需要的OH-浓度是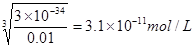 ,所以首先生成的是氢氧化铝沉淀,反应的离子方程式是Al3++3NH3·H2O==Al(OH)3↓+3NH4+
。
,所以首先生成的是氢氧化铝沉淀,反应的离子方程式是Al3++3NH3·H2O==Al(OH)3↓+3NH4+
。
(3)0.01mol·L-1的NaOH溶液的pH=11,所以溶液中氢离子浓度是1×10-11mol/L,而OH-浓度是0.01mol/L,则该温度下水的离子积常数K w=10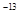 。pH=2的H2SO4溶液VaL与pH=12的NaOH溶液VbL混合,若所得混合液为中性,则
。pH=2的H2SO4溶液VaL与pH=12的NaOH溶液VbL混合,若所得混合液为中性,则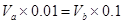 ,所以Va︰Vb=10:1。
,所以Va︰Vb=10:1。
(4)cmol·L-1的醋酸溶液与0.02mol·L-1NaOH溶液等体积混合后溶液刚好呈中性,所以根据电荷守恒可知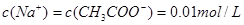 、而溶液中氢离子浓度是1×10-7mol/L.根据物料守恒可知,溶液中醋酸的浓度是0.5c-0.01,所以该温度下醋酸的电离常数Ka=
、而溶液中氢离子浓度是1×10-7mol/L.根据物料守恒可知,溶液中醋酸的浓度是0.5c-0.01,所以该温度下醋酸的电离常数Ka=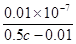 =2×10—9/(c—0.02)。
=2×10—9/(c—0.02)。
考点:考查反应热的计算、平衡常数的应用、自发反应的判断、溶度积常数的计算、pH的计算以及电离常数的计算等
点评:在利用水的离子积常数进行有关计算时,必需注意水的离子积常数与温度有关系,由于电离是吸热的,所以水的离子积常数随温度的升高而增大,只有在常温常压下pH=7的溶液才是显酸性的;同样平衡常数、溶度积常数以及电离平衡常数都是只与温度有关系的,且是在达到平衡状态对应的常数,所以在进行有关计算需要特别注意。

 阅读快车系列答案
阅读快车系列答案
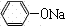 +CO2+H2O→
+CO2+H2O→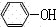 +NaHCO3;
+NaHCO3;