题目内容
(18分)下表为元素周期表中的一部分,表中列出了11种元素在周期表中的位置,按要求完成下列各小题。

(1) 化学性质最不活泼的元素是 (填元素符号或化学式,下同),
非金属性最强的元素是 。
金属性最强的单质与水反应的离子方程式是
。
(2) ①③⑤三种元素的最高价氧化物对应的水化物中,碱性最强的化合物的化学式是
(3) ①②③三种元素的原子半径由大到小的顺序是 > > 。
(4) 某元素的最高价氧化物对应的水化物既能与酸反应生成盐和水,又能和碱反应
生成盐和水,该元素的最高价氧化物和盐酸反应的离子方程式为
。
向该元素和⑧号元素形成的化合物的溶液中,缓慢滴加氨水至过量,产生的实验现象是 ,有关反应的化学方程式为 。(5)⑥元素形成的单质与浓硝酸发生化学反应的化学方程式为
。
(16分) (1) Ar,F,2K+2H2O=2K++2OH-+H2↑
(2) NaOH, (3) K>Na>Mg,
(4) Al2O3+6H+=2 Al3++3H2O
先出现白色沉淀,并逐渐增多 AlCl3+3NH3· H2O=Al(OH)3↓+ 3NH4Cl,
(5)C+4HNO3(浓)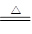 CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
【解析】考查元素周期表的结构和元素周期律的应用。根据元素在周期表中的位置可知,①~⑪分别是Na、K、Mg、Ca、Al、C、O、Cl、Br、Ar、F。
(1)稀有气体元素的最外层电子数已经达到稳定结构,所以稀有气体元素的性质最稳定,即是Ar。非金属性最强的是F。金属性最强的是钾,和水反应的方程式为K+2H2O=2K++2OH-+H2↑。
(2)金属性越强,最高价氧化物的水化物的碱性越强,金属性是Na>Mg>Al,所以氢氧化钠的碱性最强。
(3)同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,所以顺序是K>Na>Mg。
(4)氢氧化铝是两性氢氧化物,既能与酸反应生成盐和水,又能和碱反应生成盐和水,所以和盐酸反应的离子方程式为Al2O3+6H+=2 Al3++3H2O。氯化铝和氨水反应生成氢氧化铝白色沉淀,但氢氧化铝不能溶于氨水中,所以沉淀不会消失。方程式为AlCl3+3NH3· H2O=Al(OH)3↓+ 3NH4Cl。
(5)在加热的条件下,碳和浓硝酸反应生成CO2、NO2和水,方程式为C+4HNO3(浓)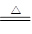 CO2↑+4NO2↑+2H2O。
CO2↑+4NO2↑+2H2O。

下表为元素周期表中的一部分,列出10种元素在元素周期表中的位置。试用元素符号、离子符号或化学式回答下列问题。
| | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | ⑥ | | ⑦ | | |
| 3 | ① | ③ | ⑤ | | ⑧ | | ⑨ | ⑩ |
| 4 | ② | ④ | | | | | | |
(2)①③⑤三种元素最高价氧化物对应水化物中,碱性最强的是 ;(填化学式)
(3)元素⑦的氢化物的化学式为 ;该氢化物常温下和元素②的单质反应的化学方程式
(4)①和⑧元素的最高价氧化物对应水化物的化学式为 和 ;③和⑨两元素形成化合物的电子式 ;①和⑦两元素形成四核化合物的电子式 ,该物质与CO2反应的化学方程式 ;
(5)①和⑤最高价氧化物对应水化物相互反应的离子方程式为


