题目内容
【题目】X、Y、Z、W 是短周期元素,其在周期表的位置如图,请找出错误选项( )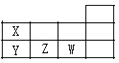
A.原子半径:Y>Z>W
B.酸性:HWO4>HXO3>H3YO4
C.热稳定性:HW>XH3>YH3
D.离子半径:Y3﹣<Z2﹣<W﹣
【答案】D
【解析】由元素在周期表的位置可知,X为N,Y为P,Z为S,W为Cl,
A.同周期从左向右原子半径减小,则原子半径:Y>Z>W,故A不符合题意;
B.非金属性Cl>N>P,酸性:HWO4>HXO3>H3YO4,故B不符合题意;
C.非金属性越强,对应氢化物越稳定,则热稳定性:HW>XH3>YH3,故C不符合题意;
D.具有相同电子排布的离子中,原子序数大的离子半径小,则离子半径:Y3﹣>Z2﹣>W﹣,故D符合题意;
所以答案是:D.

 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案【题目】某化学兴趣小组设计实验,用浓硫酸与铜的反应制取SO2并进行相关实验探究,同时获得少量NaHSO3,实验装置如下图所示:
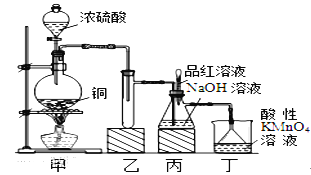
(1)装置甲中发生反应的化学方程式是________________,装置乙的作用是___________。
(2)装置丁的作用是吸收污染空气的SO2气体,其反应的离子方程为___________________。
(3)SO2气体有漂白性、还原性和氧化性。将SO2通入溴水中,SO2表现的是__________性,化学反应方程式为_________________________________。
(4)反应过程中,将丙中滴管里的品红溶液滴入锥形瓶,若现象为_____________,则溶液中的NaOH完全转化为了NaHSO3。
(5)若丙中没有加入品红溶液,则不能准确判断氢氧化钠是否完全转化。现有可供选择的仪器和试剂:烧杯、试管、玻璃棒、胶头滴管; 2mol/L盐酸、2mol/L硝酸、1mol/L氯化钡溶液、1 mol/L氢氧化钡溶液、品红溶液、蒸馏水。请设计实验探究吸收后产物中是否存在NaHSO3和Na2SO3,将实验操作、预期的实验现象和结论填在下表中。
实验操作 | 预期现象与结论 |
步骤1:取少量待测液放入试管中,滴加过量1 mol/L氯化钡溶液。静置一段时间后,得到滤液A和固体B。 | (空) |
步骤2:往固体B中加入蒸馏水洗涤沉淀,静置后弃去上层清液,向固体滴入2滴(或少量)品红,再滴加__________________。 | 若品红褪色(或有气泡),则说明含有Na2SO3。 |
步骤3:用试管取少量A,向其中加入过量___________。 | 若生成白色沉淀,则说明有NaHSO3生成 |