题目内容
【题目】如图是元素周期表的一部分:
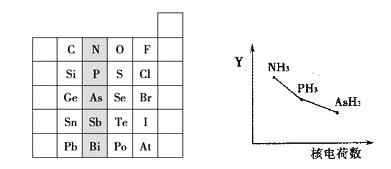
⑴ 阴影部分元素的外围电子排布式的通式为_________。Sb的元素名称为________。基态P原子中,电子占据的最高能级符号为______,该能层具有的原子轨道数为______。
⑵ 氮族元素氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如上右图所示,则Y轴可表示的氢化物(RH3)性质可能有________。
A.稳定性B.沸点C.R—H键能D.分子间作用力
⑶ 某种新型储氧材料的理论结构模型如下左图所示,图中虚线框内碳原子的杂化轨道类型有____________种。

⑷ CN-和Fe2+、Fe3+及K+能形成一种蓝色配位化合物普鲁士蓝。上右图是该物质的的结构单元(K+未标出),该图是普鲁士蓝的晶胞吗?_______ (填“是”或“不是”),平均每个晶胞中含有______个K+。

⑸磷酸盐与硅酸盐之间具有几何形态的相似性。如多磷酸盐与多硅酸盐一样,也是通过四面体单元通过共用顶角氧离子形成岛状、链状、层状、骨架网状等结构型式。不同的是多硅酸盐中是{SiO4}四面体,多磷酸盐中是{PO4}四面体。右图为一种无限长单链结构的多磷酸根,该多磷酸根的化学式为___________。
【答案】ns2np3 锑 3P 9 AC 3 不是 ![]() (PO3)nn-或PO3-
(PO3)nn-或PO3-
【解析】
(1)阴影部分元素处于ⅤA族,最外层有5个电子,其外围电子排布的通式为ns2np3,P核外还有3个电子层,则电子占据的最高层符号为M,M层还有1个s轨道、3个p轨道和5个d轨道,总共还有9个轨道,电子占有的最高能级为3p;Sb元素为锑,答案为ns2np3 锑 3P 9;
(2)A.N、P、As位于周期表同一主族,从上到下排列,根据元素周期律可以知道,非金属性越强,氢化物的稳定性越强,因此三种氢化物的稳定性逐渐降低, A选项正确;B.因为氨气分子间存在氢键,因此氨气的沸点最高,AsH3的相对分子质量大于PH3,AsH3沸点较PH3高,故B错误;C.非金属性越强与氢元素形成的共价键越强,键能越大,因此键能随原子序数的增大而减小,所以C选项是正确的;D.三种氢化物生成的晶体均是分子晶体,分子间作用力随相对分子质量的增加而增大,故D错误;答案为AC;
(3)C原子的杂化构型可以通过周围有几个原子来判断,在框图中C原子周边的原子数有3、4、2,共3种情况,球的部分基本上所有的C原子周围有3个C原子,为sp2杂化,在球和链相连的C原子其周围有4个C原子,sp3杂化,链上的C周边有2个C原子,sp杂化,答案为3。
(4) 普鲁士蓝的化学式为Fe4[Fe(CN)6]3,Fe2+和Fe3+的个数相等为![]() ,CN-的个数为
,CN-的个数为![]() ,它们的个数比不符合普鲁士蓝的化学式。在晶胞中电荷守恒,Fe2+和Fe3+所带的正电荷
,它们的个数比不符合普鲁士蓝的化学式。在晶胞中电荷守恒,Fe2+和Fe3+所带的正电荷![]() ,而CN-带的负电荷为3,K+所带的电荷为
,而CN-带的负电荷为3,K+所带的电荷为![]() ,每个晶胞中含有
,每个晶胞中含有![]() 个K+,答案为不是
个K+,答案为不是 ![]() ;
;
(5)根据图片知,每个三角锥结构中P原子是1个,O原子个数是![]() 个,所以P原子和氧原子个数之比1:3,3个O原子带6个单位负电荷,磷酸盐,P的化合价为+5,所以形成离子为(PO3)nn-或PO3-。
个,所以P原子和氧原子个数之比1:3,3个O原子带6个单位负电荷,磷酸盐,P的化合价为+5,所以形成离子为(PO3)nn-或PO3-。






