题目内容
3.进行下列化学基本量的计算,并将结果直接填入空格中.(1)0.1mol H2SO4约含H原子的个数为0.2NA个,溶于水后电离出SO42-的物质的量为0.1mol.
(2)36g水与44g CO2具有相同的氧原子数.
(3)71gNa2SO4中所含Na+的物质的量为1mol.
(4)同温同压下的氧气和氢气,若体积相同时,两种气体的质量比为16:1,其密度比为16:1;若质量相等时,两种气体的体积比1:16.
分析 (1)根据N=nNA结合分子构成计算;
(2)根据n=$\frac{m}{M}$计算;
(3)根据n=$\frac{m}{M}$结合化学式的组成分析;
(4)同温同压下的氧气和氢气,若体积相同时,物质的量相同,根据m=nM、ρ=$\frac{M}{Vm}$计算;如果二者质量相等,根据V=$\frac{m}{M}$×Vm知,相同气体摩尔体积时,其体积之比等于摩尔质量的反比.
解答 解:(1)0.1mol H2SO4中含有H的物质的量为0.2mol,则含H原子的个数为0.2NA;溶于水后电离出SO42-的物质的量为0.1mol;
故答案为:0.2NA;0.1;
(2)36g水的物质的量为$\frac{36g}{18g/mol}$=2mol,则含有的O原子为2mol,所以CO2的物质的量为1mol,则其质量为m=nM=44g;
故答案为:44;
(3)71gNa2SO4的物质的量为n=$\frac{m}{M}$=$\frac{71g}{142g/mol}$=0.5mol,则所含Na+的物质的量为1mol;
故答案为:1;
(4)同温同压下的氧气和氢气,若体积相同时,物质的量相同,由m=nM可知,两种气体的质量比等于摩尔质量之比为16:1;由ρ=$\frac{M}{Vm}$可知,气体摩尔体积相等时,二者的密度之比等于其摩尔质量之比=32g/mol:2g/mol=16:1;
如果二者质量相等,根据V=$\frac{m}{M}$知,相同气体摩尔体积时,其体积之比等于摩尔质量的反比=2g/mol:32g/mol=1:16,
故答案为:16:1;16:1;1:16.
点评 本题考查物质的量的计算,为基础性习题,把握质量、物质的量、摩尔质量的关系为解答的关键,侧重分析能力和计算能力的考查,题目难度中等.

| A. | ZnO | B. | K2CO3 | C. | Zn(OH)2 | D. | ZnCO3 |
| A. | 天然气--CO | B. | 酒精--C2H5OH | C. | 金刚石--Si | D. | 石膏--CaCO3 |
| A. | 甲烷的摩尔质量为16克 | |
| B. | 标准状况下,0.3molSO2中含氧原子数为0.3NA | |
| C. | 常温下,2.7克铝离子所带的电荷数为0.3NA | |
| D. | 常温下,9.5克MgCl2晶体中含Mg2+为0.2NA |
| A. | 硫酸与氢氧化钡反应:SO42-+Ba2+═BaSO4↓ | |
| B. | 硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ | |
| C. | 醋酸滴在锌片上:Zn+2H+═Zn2++H2↑ | |
| D. | Na2C03溶液与稀H2SO4反应:CO32-+2H+═H2O+CO2↑ |
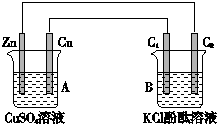 按图所示装置进行实验,并回答下列问题.
按图所示装置进行实验,并回答下列问题.