题目内容
CaC2可用于固氮:CaC2+N2  CaCN2+C,CaCN2(氰氨化钙)和水反应可生成NH3。
CaCN2+C,CaCN2(氰氨化钙)和水反应可生成NH3。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式: 。
(2)C、N、O三种元素的第一电离能由小到大的顺序是 。
(3)NH3中N原子的杂化方式为 ;根据价层电子对互斥理论推测CO32-的空间构型为 。
(4)CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有 (填写一种化学式即可);写出CaCN2水解反应的化学方程式 。
 CaCN2+C,CaCN2(氰氨化钙)和水反应可生成NH3。
CaCN2+C,CaCN2(氰氨化钙)和水反应可生成NH3。(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式: 。
(2)C、N、O三种元素的第一电离能由小到大的顺序是 。
(3)NH3中N原子的杂化方式为 ;根据价层电子对互斥理论推测CO32-的空间构型为 。
(4)CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有 (填写一种化学式即可);写出CaCN2水解反应的化学方程式 。
(1)1s22s22p63s23p63d104s2或[Ar]3d104s2(2)C O N(3)sp3 平面正三角形
(4)CO2或N2O CaCN2 +3H2O=CaCO3+2NH3↑
(4)CO2或N2O CaCN2 +3H2O=CaCO3+2NH3↑
试题分析:(1)Ca位于第四周期、最外层电子数为2,最外层电子数为2、内层排满电子的第四周期元素原子是Zn,电子排布式为1s22s22p63s23p63d104s2或[Ar]3d104s2。(2)同周期元素从左向右,第一电离能总体趋势增大,但IIA和VA反常,第一电离能:N>O>C。(3)NH3中N形成3个
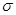 键,还有1对孤对电子,N杂化类型为sp3。CO32-中C价层电子对数=
键,还有1对孤对电子,N杂化类型为sp3。CO32-中C价层电子对数= 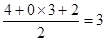 ,C与3个O成键,空间构型为平面三角形。(4)等电子体原子数相同、价电子数相同。C2-与O原子数相等,所以与CN22-互为等电子体的分子有N2O,N2与CO互为等电子体,与N2O互为等电子体的分子有CO2、BeCl2等。CaCN2与水生成NH3,同时生成CaCO3。
,C与3个O成键,空间构型为平面三角形。(4)等电子体原子数相同、价电子数相同。C2-与O原子数相等,所以与CN22-互为等电子体的分子有N2O,N2与CO互为等电子体,与N2O互为等电子体的分子有CO2、BeCl2等。CaCN2与水生成NH3,同时生成CaCO3。
练习册系列答案
相关题目
