题目内容
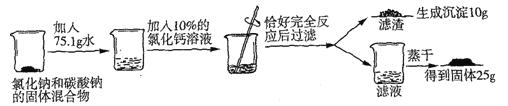
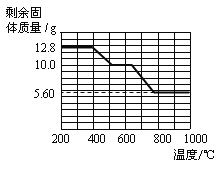
【题目】取一定质量的石灰石(杂质不溶于水,也不与酸反应)高温煅烧一段时间后得111.2g固体,向其中加入500g质量分数为14.6%的稀盐酸继续有气泡产生,至固体不再减少时过滤,得一定质量的中性溶液和20g不溶物(滤渣),则煅烧和加入盐酸两次反应产生气体的质量比为
A.1:1 B.1:2 C.1:3 D.1:4
【答案】A
【解析】
试题分析:石灰石煅烧,发生分解反应,产生CaO和CO2,向其中加入HCl,发生反应:CaO+2HCl=CaCl2+H2O,n(HCl)= (500g×14.6%)÷36.5g/mol=2mol,根据反应方程式:CaCO3![]() CaO+ CO2↑;根据方程式可得关系式:CaCO3~CaO~2HCl,所以CaCO3的物质的量是n(CaCO3)=1/2n(HCl)=1mol,CaCO3
CaO+ CO2↑;根据方程式可得关系式:CaCO3~CaO~2HCl,所以CaCO3的物质的量是n(CaCO3)=1/2n(HCl)=1mol,CaCO3![]() CaO+ CO2↑反应产生CO2的物质的量是1mol,根据方程式CaCO3+2HCl=CaCl2+CO2↑+H2O可知1molCaCO3发生复分解反应,产生CO2的物质的量是1mol,故煅烧和加入盐酸两次反应产生气体的质量相等,二者的比为1:1,选项A正确。
CaO+ CO2↑反应产生CO2的物质的量是1mol,根据方程式CaCO3+2HCl=CaCl2+CO2↑+H2O可知1molCaCO3发生复分解反应,产生CO2的物质的量是1mol,故煅烧和加入盐酸两次反应产生气体的质量相等,二者的比为1:1,选项A正确。

练习册系列答案
相关题目