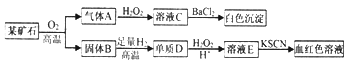
题目内容
【题目】现有AlCl3和MgSO4混合溶液,向其中不断加入0.1mol/L 的NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl﹣与SO42﹣的物质的量之比为( ) 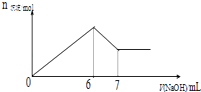
A.2:1
B.2:3
C.6:1
D.3:1
【答案】A
【解析】解:由图可知加入6mLNaOH溶液,沉淀达最大量,沉淀为Mg(OH)2、Al(OH)3 , 根据氢氧根守恒可知2n[Mg(OH)2]+3n[Al(OH)3]=n(OH﹣)=0.006L×1mol/L=0.006mol,
加入7mL NaOH溶液时,沉淀由最大值减小为最小值,故1mL NaOH溶液溶解氢氧化铝沉淀,根据反应Al(OH)3+NaOH=NaAlO2+2H2O可知,n[Al(OH)3]=n(NaOH)=0.001L×1mol/L=0.001mol,所以n[Mg(OH)2]= ![]() =0.0015mol,
=0.0015mol,
溶液中n(Cl﹣)=3n[Al(OH)3]=0.003mol,原溶液中n(SO42﹣)=n[Mg(OH)2]=0.0015mol,
所以原溶液中Cl﹣与SO42﹣的物质的量之比为0.003mol:0.0015mol=2:1,
故选:A.
由图可知加入6mLNaOH溶液,沉淀达最大量,沉淀为Mg(OH)2、Al(OH)3 , 根据氢氧根守恒可知2n[Mg(OH)2]+3n[Al(OH)3]=n(OH﹣),加入0.7mL NaOH溶液时,沉淀由最大值减小为最小值,故1ml NaOH溶液溶解氢氧化铝沉淀,根据反应Al(OH)3+NaOH=NaAlO2+2H2O计算n[Al(OH)3],再计算出n[Mg(OH)2],进而计算原溶液中Cl﹣与SO42﹣的物质的量浓度之比.

练习册系列答案
相关题目