题目内容
【题目】(1)0.1molCH4 的质量为__________,分子数为__________(用NA表示,下同),原子总数为_________。
(2)500 mL 0.2 mol·L-1的Ba(NO3)2溶液中,NO3-的物质的量的浓度为______________,离子总数为_____________。
(3)在22 .2g某二价金属的氯化物中含有0 .4mol Cl-,此氯化物的摩尔质量为________,该金属元素的相对原子质量为__________。
(4)在标准状况下,由O2和O3组成的混合气体11.2 L,质量为20g。此混合物的平均摩尔质量是________,混合物中O2和O3的体积之比是__________。
【答案】1.6g 0.1NA 0.5NA 0.4mol·L-1 0.3NA 111g·mol-1 40 40g·mol-1 1:1
【解析】
结合n=![]() =
=![]() =
=![]() =cV计算分析即可。
=cV计算分析即可。
(1)0.1molCH4 的质量为16g/mol×0.1mol=1.6g,分子数为0.1NA,每个CH4分子内含有5个原子,则原子总数为0.5NA;
(2)500 mL 0.2 mol·L-1的Ba(NO3)2溶液中NO3-的物质的量的浓度为0.2 mol·L-1×2=0.4 mol·L-1;Ba(NO3)2的物质的量为0.2 mol·L-1×0.5L=0.1mol,离子总数为0.1mol×3×NA mol-1=0.3NA;
(3) 某二价金属的氯化物的化学式为RCl2,在22 .2g某二价金属的氯化物中含有0 .4mol Cl-,此氯化物的物质的量为![]() =0.2mol,则氯化物的摩尔质量为
=0.2mol,则氯化物的摩尔质量为![]() =111g·mol-1,该金属元素的相对原子质量为111-35.5×2=40;
=111g·mol-1,该金属元素的相对原子质量为111-35.5×2=40;
(4)在标准状况下,由O2和O3组成的混合气体11.2 L,则混合气体的物质的量总和为![]() =0.5mol, 此混合物的平均摩尔质量是
=0.5mol, 此混合物的平均摩尔质量是![]() =4040g·mol-;设O2的物质的量为nmol,则O3的物质的量为(0.5-n)mol,此时32n+48(0.5-n)=40,解得:n=0.25,则混合物中O2和O3的体积之比是0.25mol:0.25mol=1:1。
=4040g·mol-;设O2的物质的量为nmol,则O3的物质的量为(0.5-n)mol,此时32n+48(0.5-n)=40,解得:n=0.25,则混合物中O2和O3的体积之比是0.25mol:0.25mol=1:1。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
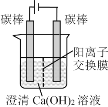
小学生10分钟应用题系列答案【题目】某研究小组在电压为24V时进行如下实验,电解3分钟后,发现下列现象。
编号 | ① | ② | ③ |
装置 |
|
|
|
现象 | 小灯泡微弱发光,两极均产生气泡,阳极附近出现白色浑浊,阴极附近无明显变化 | 两极均产生气泡,溶液无明显变化 | 两极均产生气泡,阳极附近出现白色浑浊,阴极附近无明显变化 |
下列说法正确的是( )
A.①中小灯泡微亮是因为Ca(OH)2是弱电解质
B.对比①和②,白色浑浊的出现与电极材料无关
C.对比①和③,白色浑浊是由于OH-迁移到阳极使Ca(OH)2沉淀析出
D.阳极附近白色沉淀的成分可能是CaCO3