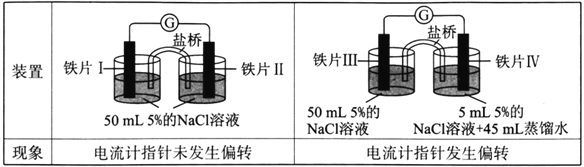
��Ŀ����
����Ŀ����ѧ��Ӧ�����У����������ʵı仯��ͬʱ�����������ı仯��
��1����֪H��(aq)��OH��(aq)===H2O(l)����H����57.3 kJ��mol��1���ش������й��кͷ�Ӧ��Ӧ�ȵ����⡣
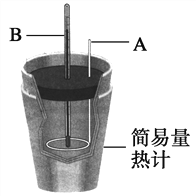
����0.1 mol H2SO4���ϡ��Һ���Թ���NaOH��Ӧ���ܷų�________ kJ��������ʵ�������Թ�����NaOH��ԭ����_____________
����ͼװ��������A��������_____��������______________________��
������ͬŨ�Ⱥ�����İ�ˮ(NH3��H2O)����NaOH��Һ��������ʵ�飬��õ���H_____________(����ƫ��������ƫС��������Ӱ����)��
��2����֪���� lmol H��H����lmol N��H����lmolN��N���ֱ���Ҫ��������a kJ��b kJ��c kJ����N2(g) + 3H2(g)��2NH3(g) ��H��_______kJ/mol��(��a��b��c��ʾ)
���𰸡� 11.46 ��֤H2SO4��ȫ���к� ���β�������� ���裬ʹ��Һ��ֻ�� ƫ�� (c+3a��6b)����(6b��3a��c)
��������(1). ��. 0.1mol����ϡ��Һ�������ӵ����ʵ���Ϊn(H��)=0.2mol����H��(aq)��OH��(aq)=H2O(l)����H����57.3 kJ��mol��1��֪�����Թ�����NaOH��Ӧʱ���ų�������Ϊ��0.2mol��57.3 kJ��mol��1=11.46kJ����ʵ�������Թ�����NaOH������ʹH2SO4��ȫ��Ӧ���ʴ�Ϊ��11.46����֤H2SO4��ȫ���к���
��. ����A�������ǻ��β�����������������ǽ��裬ʹ��Һ��ֻ�Ϸ�Ӧ���ʴ�Ϊ�����β�������������裬ʹ��Һ��ֻ�ϣ�
��. NH3��H2O�������������Ϊ���ȹ�����������ͬŨ�Ⱥ�����İ�ˮ(NH3��H2O)����NaOH��Һ��������ʵ�飬���շų�������ƫ�٣���õ���Hƫ�����ʴ�Ϊ��ƫ��
(2). ��Ӧ�ȵ��ڷ�Ӧ������ܺͼ�ȥ����������ܺͣ���N2(g) + 3H2(g)��2NH3(g)����H=(c+3a��6b)kJ/mol����(6b��3a��c)kJ/mol���ʴ�Ϊ��(c+3a��6b)����(6b��3a��c)��