题目内容
已知:A、B、C、D四种元素的原子序数依次增大。A与C原子的价电子构型相同,A的第一电离能是同族中最大的;B原子核外有三个未成对电子,C原子的价电子构型为3s1,D原子的3p轨道上有两对成对电子。
(1)A、B形成的10电子分子中,分子空间构型为 。该分子常常作为配位体形成络合物,请写出其与Zn(OH)2反应形成的络合物的化学式
(2)B原子和氧原子相比 的第一电离能更大。
(3)A分别与B、D形成的常见化合物在水中的溶解度都很大,其中 (写化学式)的溶解度更大,原因是 。
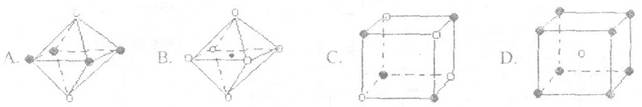
(4)下列图象是从某些晶体结构图中分割出来的部分结构图,试判断其中符合元素C、D形成的晶体结构的图象是 .
(1)三角锥形;[Zn(NH3)4](OH)2
(2)B(或N)
(3)NH3;NH3和H2O之间可以形成氢键,而HCl与H2O之间不能
(4)BC

练习册系列答案
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案
相关题目
 (2011?新余二模)化学--选修物质结构与性质
(2011?新余二模)化学--选修物质结构与性质
 已知:A、B、C、D、E、F、X为周期表中前四周期的七种元素,它们的原子序数依次增大.A是周期表中原子半径最小的元素;B的基态原子有3个不同的能级,各能级中电子数相等;D的基态原子2p能级上的未成对电子数与B原子的相同;D2-离子与E2+离子具有相同的稳定电子层结构;F有“生物金属”之称,F4+离子和氩原子的核外电子排布相同;X的基态原子的价电子排布式为3d84s2.
已知:A、B、C、D、E、F、X为周期表中前四周期的七种元素,它们的原子序数依次增大.A是周期表中原子半径最小的元素;B的基态原子有3个不同的能级,各能级中电子数相等;D的基态原子2p能级上的未成对电子数与B原子的相同;D2-离子与E2+离子具有相同的稳定电子层结构;F有“生物金属”之称,F4+离子和氩原子的核外电子排布相同;X的基态原子的价电子排布式为3d84s2.
 已知单质A、B、C、D有如下的反应关系.其中A 在B中燃烧时,火焰呈苍白色; C在B中燃烧时生成棕黄色的烟,E的水溶液呈蓝绿色,G是一种黑色固体.
已知单质A、B、C、D有如下的反应关系.其中A 在B中燃烧时,火焰呈苍白色; C在B中燃烧时生成棕黄色的烟,E的水溶液呈蓝绿色,G是一种黑色固体.