题目内容
某同学设计下列方法对A盐的水溶液进行鉴定,由此得出的结论中,不正确的是( )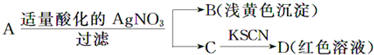

| A.D溶液中存在Fe(SCN)3 | B.滤液中有Fe3+ |
| C.B为AgBr | D.A一定为无氧酸盐FeBr2 |
由图中转化可知,B为A与硝酸银反应生成的浅黄色沉淀,根据元素守恒知则为AgBr,所以A中含有Br-,C中加KSCN溶液变为血红色溶液,所以D为Fe(SCN)3溶液,则C中含有Fe3+,A中含有铁元素,硝酸具有强氧化性,能氧化亚铁离子生成铁离子,所以A为可能含有Fe3+或Fe2+,
A.通过以上分析知,D中含有Fe(SCN)3,故A正确;
B.C能和硫氰化钾溶液反应生成血红色溶液,说明C中含有Fe3+,故B正确;
C.能和银离子反应生成淡黄色沉淀的离子是溴离子,所以B是溴化银,故C正确;
D.硝酸具有强氧化性,能将亚铁离子氧化生成铁离子,所以A中可能是FeBr2,也可能是FeBr3,也可能是二者的混合物,故D错误;
故选D.
A.通过以上分析知,D中含有Fe(SCN)3,故A正确;
B.C能和硫氰化钾溶液反应生成血红色溶液,说明C中含有Fe3+,故B正确;
C.能和银离子反应生成淡黄色沉淀的离子是溴离子,所以B是溴化银,故C正确;
D.硝酸具有强氧化性,能将亚铁离子氧化生成铁离子,所以A中可能是FeBr2,也可能是FeBr3,也可能是二者的混合物,故D错误;
故选D.

练习册系列答案
 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案
相关题目

 .以下推断不正确的是( )
.以下推断不正确的是( )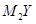 。下列说法正确的是( )
。下列说法正确的是( ) 、M
、M