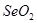题目内容
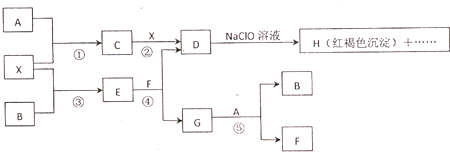
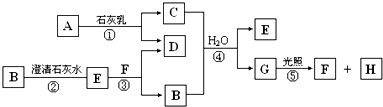
A-H及X均为中学化学常见物质,X是一种金属单质,A在常温下为黄绿色气体,B在常温下为固体.它们在一定条件下有如图转化关系(图中条件均已略去).
试回答下列问题:
(1)写出C物质的化学式______;
(2)在上述①一⑤反应中肯定不属于氧化还原反应的是______(填编号);
(3)指出元素x在元素周期表中的位置:第______周期,第______族;
(4)请写出反应③和⑤的化学方程式:③______,⑤______
(5)用离子方程式表示在D.溶液中加入NaClO溶液产生红褐色沉淀的原因______.

试回答下列问题:
(1)写出C物质的化学式______;
(2)在上述①一⑤反应中肯定不属于氧化还原反应的是______(填编号);
(3)指出元素x在元素周期表中的位置:第______周期,第______族;
(4)请写出反应③和⑤的化学方程式:③______,⑤______
(5)用离子方程式表示在D.溶液中加入NaClO溶液产生红褐色沉淀的原因______.
红褐色沉淀H为Fe(OH)3,由题意知X为金属,结合质量守恒定律可推知X为Fe,A在常温下为黄绿色气体,为Cl2,结合反应①②知C为FeCl3、D为FeCl2,在D溶液中加入NaClO溶液产生红褐色沉淀,一方面FeCl2被NaClO氧化为Fe3+,另一方面Fe3+与ClO-发生双水解反应生成Fe(OH)3和HClO.B在常温下为固体,由反应③④可知,B为硫、E为FeS、F为HCl、G为H2S,反应⑤为氯气与硫化氢反应生成S与HCl,符合转化关系,
(1)由上述分析可知,C为FeCl3,故答案为:FeCl3;
(2)在上述①一⑤反应中,反应④时FeS与HCl反应生成FeCl2、H2S,元素化合价没有发生变化,不属于氧化还原反应,反应①②③时由单质参加的化合反应,反应⑤属于置换反应,①②③⑤都属于氧化还原反应,故答案为:④;
(3)元素x为Fe,在元素周期表中的位置:第四周期第Ⅷ族,故答案为:四;Ⅷ;
(4)反应③是Fe与S反应生成FeS,反应方程式为:Fe+S
FeS,
反应⑤时氯气与硫化氢反应生成S与HCl,反应方程式为:H2S+Cl2=S↓+2HCl,
故答案为:Fe+S
FeS;H2S+Cl2=S↓+2HCl;
(5)在D溶液中加入NaClO溶液产生红褐色沉淀,一方面FeCl2被NaClO氧化为Fe3+,另一方面Fe3+与ClO-发生双水解反应生成Fe(OH)3和HClO,反应离子方程式为:2Fe2++ClO-+4OH-+H2O=2Fe(OH)3+Cl-或 6Fe2++3ClO-+3H2O=2Fe(OH)3+3Cl-+4Fe3+,
故答案为:2Fe2++ClO-+4OH-+H2O=2Fe(OH)3+Cl-或 6Fe2++3ClO-+3H2O=2Fe(OH)3+3Cl-+4Fe3+.
(1)由上述分析可知,C为FeCl3,故答案为:FeCl3;
(2)在上述①一⑤反应中,反应④时FeS与HCl反应生成FeCl2、H2S,元素化合价没有发生变化,不属于氧化还原反应,反应①②③时由单质参加的化合反应,反应⑤属于置换反应,①②③⑤都属于氧化还原反应,故答案为:④;
(3)元素x为Fe,在元素周期表中的位置:第四周期第Ⅷ族,故答案为:四;Ⅷ;
(4)反应③是Fe与S反应生成FeS,反应方程式为:Fe+S
| ||
反应⑤时氯气与硫化氢反应生成S与HCl,反应方程式为:H2S+Cl2=S↓+2HCl,
故答案为:Fe+S
| ||
(5)在D溶液中加入NaClO溶液产生红褐色沉淀,一方面FeCl2被NaClO氧化为Fe3+,另一方面Fe3+与ClO-发生双水解反应生成Fe(OH)3和HClO,反应离子方程式为:2Fe2++ClO-+4OH-+H2O=2Fe(OH)3+Cl-或 6Fe2++3ClO-+3H2O=2Fe(OH)3+3Cl-+4Fe3+,
故答案为:2Fe2++ClO-+4OH-+H2O=2Fe(OH)3+Cl-或 6Fe2++3ClO-+3H2O=2Fe(OH)3+3Cl-+4Fe3+.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目


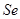 )是人体必需的微量元素,在元素周期表中的位置如下图。下列关于硒元素的叙述正确的是
)是人体必需的微量元素,在元素周期表中的位置如下图。下列关于硒元素的叙述正确的是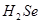 比
比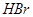 稳定
稳定