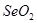题目内容
(8分)研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题。
(1)C、Si、N元素的电负性由大到小的顺序是__________________。
(2)A、B均为短周期金属元素。依据下表数据,写出B原子的电子排布式:______________。
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,过渡金属离子为d0或d10排布时,无颜色,d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色。据此判断,[Mn(H2O)6]2+________颜色(填“无”或“有”)。
(4)利用CO可以合成化工原料COCl2。请判断COCl2分子内含有________。
A.4个σ键 B.2个σ键、2个π键 C.2个σ键、1个π键 D.3个σ键、1个π键
(1)C、Si、N元素的电负性由大到小的顺序是__________________。
(2)A、B均为短周期金属元素。依据下表数据,写出B原子的电子排布式:______________。
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4[来源: |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
(4)利用CO可以合成化工原料COCl2。请判断COCl2分子内含有________。
A.4个σ键 B.2个σ键、2个π键 C.2个σ键、1个π键 D.3个σ键、1个π键
(6分) (1)N>C>Si (2分)(2)1s22s22p63s2 (2分)(3)有 (4)D(其余每空1分)
(1)非金属性越强,电负性越大,所以C、Si、N元素的电负性由大到小的顺序是N>C>Si。
(2)根据AB原子的电离能数据可知,该元素是第ⅡA元素。同主族自上而下金属性逐渐增强,第一电离能逐渐减小,所以B是镁,电子排布式1s22s22p63s2。
(3)根据构造原理可知,Mn的3d电子含有5个电子,所以[Mn(H2O)6]2+有颜色。
(4)COCl2分子中含有1个碳氧双键、2个碳氯键,由于双键是由1个σ键、1个π键构成的,所以分子中含有3个σ键、1个π键,答案选D。
(2)根据AB原子的电离能数据可知,该元素是第ⅡA元素。同主族自上而下金属性逐渐增强,第一电离能逐渐减小,所以B是镁,电子排布式1s22s22p63s2。
(3)根据构造原理可知,Mn的3d电子含有5个电子,所以[Mn(H2O)6]2+有颜色。
(4)COCl2分子中含有1个碳氧双键、2个碳氯键,由于双键是由1个σ键、1个π键构成的,所以分子中含有3个σ键、1个π键,答案选D。

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目


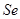 )是人体必需的微量元素,在元素周期表中的位置如下图。下列关于硒元素的叙述正确的是
)是人体必需的微量元素,在元素周期表中的位置如下图。下列关于硒元素的叙述正确的是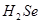 比
比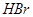 稳定
稳定