题目内容
【题目】化学能在一定条件下能够转化为电能,构成原电池。
(1)根据构成原电池的本质判断,如下反应可以设计成原电池的是(填序号)______。
A.NaOH+HCl=NaCl+H2O B.Na2CO3+2HCl=2NaCl+H2O+CO2↑
C.2H2O=2H2↑+O2↑ D.Cu+2AgNO3=2Ag+Cu(NO3)2
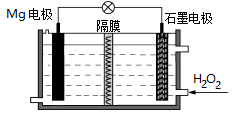
(2)为了探究化学反应中的能量变化,某同学设计了如下两个实验。有关实验现象,下列说法正确的是:_______(填序号)
A.图I和图II的气泡均产生在锌棒表面
B.图II中产生气体的速度比I快
C.图I中温度计的示数高于图II的示数
D.图I和图II中温度计的示数相等,且均高于室温
(3)大气污染越来越成为人们关注的问题.烟气中的NOx必须脱除(即脱硝)后才能排放。己知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=一890.3kJ·mol-l
N2(g)+O2(g)=2NO(g) △H=+180kJ·mol-1
CH4可用于脱硝,写出该反应热化学反应式________。
(4)如图是甲烷燃料电池原理示意图,回答下列问题:
①电他的负极反应式为:__________。
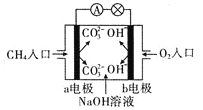
②电池工作一段时间后电解质溶液的pH________(填“增大”“减小”或“不变”)。
(5)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃料电池。试写出该电池的正极反应式_________。
【答案】 D B C CH4(g)+4NO(g)===CO2(g)+2N2(g)+2H2O(l),ΔH=-1250.3KJ/mol CH4-8e-+10OH-=CO32-+7H2O 减小 N2+6e-+8H+=2NH4+
【解析】(1)原电池发生的是自发的氧化还原反应;A.NaOH+HCl=NaCl+H2O是复分解反应,不是氧化还原反应,故A错误;B. Na2CO3+2HCl=2NaCl+H2O+CO2↑是复分解反应,不是氧化还原反应,故A错误;C. 2H2O=2H2↑+O2↑是氧化还原反应,但不能自发进行,故C错误;D. Cu+2AgNO3=2Ag+Cu(NO3)2是自发的氧化还原反应,可设计成原电池,故D正确;
(2)图I发生的锌的化学腐蚀,而图II形成了锌-铜原电池;A.图II铜为正极,铜的表面有气泡产生,故A错误;B.利用原电池反应可使金属与酸反应的速率加快,则图II中产生气体的速度比I快,故B正确;C.图I主要是将化学能转化为热能,而图II主要是将化学能转化为电能,则图I温度计的示数高于图II的示数,故C正确;D.由选项C分析可知,图I和图II中温度计的示数不相等,但均高于室温,故D错误;答案为BC;
(3)已知:①CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-890.3kJmol-1
②N2(g)+O2(g)═2NO(g);△H=+180kJmol-1,根据盖斯定律:①-2×②得CH4(g)+4NO(g)═CO2(g)+2N2(g)+2H2O(l),△H=-890.3kJmol-1-2×(+180kJmol-1)=-1250.3 kJmol-1;
(4)①甲烷燃料电池中,通入氧气的极为原电池的正极,通甲烷的极为负极,发生氧化反应,在碱性环境下,电极反应式为CH4-8e-+10OH-=CO32-+7H2O;
②根据电池的两极反应,在转移电子一样的情况下,消耗了溶液中的氢氧根离子,所以溶液的碱性减弱,pH减小;
(5)正极上氮气得电子和氢离子反应生成铵根离子,即电极反应为N2+8H++6e-═2NH4+。