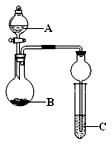
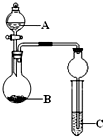
题目内容
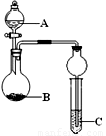
 下列几个实验可快速制取实验所需的少量气体,并进行相关性质实验.(实验装置如图所示)
下列几个实验可快速制取实验所需的少量气体,并进行相关性质实验.(实验装置如图所示)(1)若A中为30%的H2O3溶液,B中固体为MnO2,C中盛有FeCl2和KSCN的混合液,旋开E后,C中的现象是变红色,C中发生氧化还原反应的离子方程式是
(2)若A中浓盐酸,B中装有固体KMnO4,C中盛有KI淀粉溶液,旋开E后,B中出现哈绿色气体.已知1mol KMnO4发生反应时转移5mol电子,且生成的气体为单质.B中发生反应的化学方程式是
(3)若B中是生石灰,将A中液体逐滴加入B内,C中盛有铝盐溶液,试验中观察到C出现沉淀,最后沉淀也不溶解,A中液体名称是
分析:(1)根据H2O2溶液在MnO2 作催化剂的条件下分解制氧气,氧气能氧化Fe2+生成Fe3+,Fe3+遇KSCN的溶液变红;
(2)根据浓盐酸能被KMnO4氧化生成氯气,氯气能氧化I-生成I2,氯气过量,碘单质被过量的氯气氧化生成IO3-;
(3)Al3+与NH3?H2O反应生成Al(OH)3沉淀,该沉淀不溶于弱碱NH3?H2O,氨气极易溶于水,所以要防倒吸.
(2)根据浓盐酸能被KMnO4氧化生成氯气,氯气能氧化I-生成I2,氯气过量,碘单质被过量的氯气氧化生成IO3-;
(3)Al3+与NH3?H2O反应生成Al(OH)3沉淀,该沉淀不溶于弱碱NH3?H2O,氨气极易溶于水,所以要防倒吸.
解答:解:(1)因H2O2溶液在MnO2 作催化剂的条件下分解制氧气,有气泡逸出,氧气能氧化Fe2+生成Fe3+,Fe3+遇KSCN的溶液变红,C中发生氧化还原反应的离子方程式是4Fe2++O2+4H+=4Fe3++2H2O,
故答案为:4Fe2++O2+4H+=4Fe3++2H2O;
(2)浓盐酸能被KMnO4氧化生成氯气:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,氯气能氧化I-:Cl2+2KI=I2+2KCl,I2遇淀粉变蓝;过量的氯气能继续氧化碘单质生成IO3-,所以蓝色褪去,
故答案为:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O;溶液变蓝; 碘单质被过量的氯气氧化(生成IO3-),所以蓝色褪去;
(3)若B中是生石灰,将A中液体逐滴加入B内,C中盛有铝盐溶液,实验中观察到C出现沉淀,最后沉淀也不溶解,这是实验室制备Al(OH)3沉淀的方法,其反应离子方程式为Al3++3NH3?H2O=Al(OH)3↓+3NH4+,所以A中的液体为浓氨水,因氨气极易溶于水,吸收时要防倒吸,
故答案:浓氨水;Al3++3NH3?H2O=Al(OH)3↓+3NH4+;防止倒吸.
故答案为:4Fe2++O2+4H+=4Fe3++2H2O;
(2)浓盐酸能被KMnO4氧化生成氯气:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,氯气能氧化I-:Cl2+2KI=I2+2KCl,I2遇淀粉变蓝;过量的氯气能继续氧化碘单质生成IO3-,所以蓝色褪去,
故答案为:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O;溶液变蓝; 碘单质被过量的氯气氧化(生成IO3-),所以蓝色褪去;
(3)若B中是生石灰,将A中液体逐滴加入B内,C中盛有铝盐溶液,实验中观察到C出现沉淀,最后沉淀也不溶解,这是实验室制备Al(OH)3沉淀的方法,其反应离子方程式为Al3++3NH3?H2O=Al(OH)3↓+3NH4+,所以A中的液体为浓氨水,因氨气极易溶于水,吸收时要防倒吸,
故答案:浓氨水;Al3++3NH3?H2O=Al(OH)3↓+3NH4+;防止倒吸.
点评:本题主要考查了气体的制备与性质,根据物质的性质得出实验现象,培养了学生分析问题和解决问题的能力,题目难度中等.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
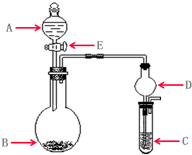
 用下列几个实验,可快速制取实验室所需的少量气体,并进行相关性质实验.(实验装置如图所示)
用下列几个实验,可快速制取实验室所需的少量气体,并进行相关性质实验.(实验装置如图所示)