题目内容
(12分)
用下列几个实验,可快速制取实验室所需的少量气体,并进行相关性质实验。(实验装置如图所示)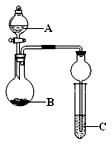
(1)若B中是生石灰,C中盛有AlCl3溶液,将A中液体逐滴加入B内,实验中观察到C溶液中出现白色沉淀。则A中液体的是 (填名称),C中发生反应的离子方程式为 。
(2)若要制O2,B为黑色固体,A中的试剂是 (填化学式),C中盛有FeCl2和KSCN的混合液,旋开分液漏斗的开关后,发现C中溶液变为血红色,写出C 中发生氧化还原反应的离子方程式 。
(3)已知氧化性强弱:KMnO4>Cl2>KIO3>I2。若A中装有浓盐酸,B中装有固体KMnO4,C中盛有KI淀粉溶液,C中的现象是 ,继续反应一段时间后,发现C中溶液的颜色褪去,这是因为 。
(12分)
(1)浓氨水(2分) Al3++3NH3·H2O = Al(OH)3↓+3NH4+ (2分)
(2) H2O2(2分) 4Fe2++O2+4H+===4Fe3++2H2O (2分)
(3)溶液变蓝(2分),在溶液中碘单质被过量氯气氧化,所以蓝色褪去(2分)
解析

练习册系列答案
相关题目