题目内容
2.在NaCl与MgCl2的混合物中,Na+与Mg2+的物质的量之比为3:2.(1)求混合物中两种物质的质量比.
(2)如果混合物中共有28mol Cl-,则混合物中氯化钠和氯化镁的质量各是多少?
(3)若在(2)的混合物中加入过量的NaOH溶液,可得沉淀多少克?
分析 (1)Na+与Mg2+的物质的量之比为3:2,则NaCl与MgCl2的物质的量之比为3:2,进而可计算质量比;
(2)如果混合物中共有28mol Cl-,设NaCl与MgCl2的物质的量分别为3xmol、2xmol,计算各自的物质的量,可计算质量;
(3)根据MgCl2的物质的量计算生成氢氧化镁的物质的量,可计算沉淀的质量.
解答 解:(1)Na+与Mg2+的物质的量之比为3:2,则NaCl与MgCl2的物质的量之比为3:2,则质量比为3×58.5:2×95=35.1:38,
答:混合物中两种物质的质量比为35.1:38;
(2)如果混合物中共有28mol Cl-,设NaCl与MgCl2的物质的量分别为3xmol、2xmol,则3xmol+2mol×2=28,x=4,即NaCl与MgCl2的物质的量分别为12mol、8mol,则m(NaCl)=12mol×58.5g/mol=702g,m(MgCl2)=8mol×95g/mol=760g,
答:混合物中氯化钠和氯化镁的质量各是702g、760g;
(3)8mol氯化镁生成8mol氢氧化镁,质量为8mol×58g/mol=464g,
答:可得沉淀464克.
点评 本题考查物质的量的计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握相关计算公式的运用,难度不大.

练习册系列答案
相关题目
13.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 18g H2O含有NA个氢原子 | |
| B. | 1.6g氧气含有氧原子的数目为0.1NA | |
| C. | 1mol CO2中含有原子数为NA | |
| D. | 含NA个钠的Na2SO4的物质的量是1mol |
10.实验室需要8.6%的氯化钠溶液100g,某同学用托盘天平称量氯化钠(不到1g的用游码),他把砝码放在左盘,氯化钠放在右盘,当天平平衡时,所称取的氯化钠的实际质量应是( )
| A. | 9.2g | B. | 8.6g | C. | 8g | D. | 7.4g |
17.下列有关14g N2的说法正确的是( )
| A. | 体积为11.2L | B. | 物质的量为0.5mol | ||
| C. | 含有6.02×1023个分子 | D. | 与1g H2的体积一定相同 |
14.下列叙述中,正确的是( )
| A. | 标准状况下,22.4L水所含的原子数目为3NA | |
| B. | 一定条件下,等物质的量甲烷和一氧化碳所含的分子数可能不相等 | |
| C. | 1L一氧化碳气体一定比1L氧气的质量小 | |
| D. | 标准状况下,17g氨气的体积约为22.4L |
2.S2Cl2是一种金黄色易挥发的液体,常用作橡胶硫化剂.某化学兴趣小组 拟设计实验制备少量的S2Cl2,査阅资料知S2Cl2在水中易发生歧化反应(一部分硫元素化 合价升高,另一部分化合价降低).加热条件下硫单质和干燥、纯净的Cl2反应即可生成S2Cl2,反应的化学方程式为:2S+Cl2$\frac{\underline{\;95~100℃\;}}{\;}$S2Cl2.
反应涉及的几种物质的熔沸点如下:
 该小组设计的制备装置如图(夹持仪器已略去),回答下列问题:
该小组设计的制备装置如图(夹持仪器已略去),回答下列问题:
(1)连接好实验装置后的第一步实验操作是检查装置的气密性.
(2)实验中需要加热的仪器是AD.(填写字母)
(3)装置B、C中的试剂分别是饱和食盐水、浓硫酸.
(4)装置D中仪器a的作用是冷凝回流、导气.
(5)反应结束后从锥形瓶内混合物中分离出产品的方法是蒸馏.
(6)若实验过程中缺少C装置,发现产品浑浊不清,请用化学方程式表示其原因2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑
(7)实验完毕,小组中的一位同学把剩余浓盐酸倒入E烧杯中,发现有黄绿色剌激性气 体产生.用离子方程式表示产生该现象的原因ClO-+2H++Cl-=Cl2↑+H2O.
反应涉及的几种物质的熔沸点如下:
| 物质 | S | S2Cl2 |
| 沸点/℃ | 445 | 138 |
| 熔点/℃ | 113 | -76 |
 该小组设计的制备装置如图(夹持仪器已略去),回答下列问题:
该小组设计的制备装置如图(夹持仪器已略去),回答下列问题:(1)连接好实验装置后的第一步实验操作是检查装置的气密性.
(2)实验中需要加热的仪器是AD.(填写字母)
(3)装置B、C中的试剂分别是饱和食盐水、浓硫酸.
(4)装置D中仪器a的作用是冷凝回流、导气.
(5)反应结束后从锥形瓶内混合物中分离出产品的方法是蒸馏.
(6)若实验过程中缺少C装置,发现产品浑浊不清,请用化学方程式表示其原因2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑
(7)实验完毕,小组中的一位同学把剩余浓盐酸倒入E烧杯中,发现有黄绿色剌激性气 体产生.用离子方程式表示产生该现象的原因ClO-+2H++Cl-=Cl2↑+H2O.
3.下列各项中表达正确的是( )
| A. | 氮气的分子式:N≡N | B. | Na+结构示意图是: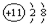 | ||
| C. | 乙醇的结构简式C2H6O | D. | HClO的电子式: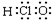 |
 根据下列转化关系,回答有关问题:
根据下列转化关系,回答有关问题: