题目内容
某温度下,将氯气通入氢氧化钾溶液中,反应后得到氯化钾、次氯酸钾和氯酸钾的混合溶液,已知被还原的氯原子与被氧化的氯原子的物质的量之比是4:1,则溶液中ClO-与ClO3-的物质的量浓度之比为( )
| A、1:3 | B、10:3 |
| C、2:3 | D、1:2 |
考点:氧化还原反应的计算,氯气的化学性质
专题:卤族元素
分析:Cl2生成ClO-与ClO3-是被氧化的过程,Cl2生成KCl是被还原的过程,氧化还原反应中氧化剂和还原剂之间得失电子数目相等,以此计算ClO-与ClO3-的物质的量浓度之比,以此来解答.
解答:
解:Cl2生成ClO-与ClO3-是被氧化的过程,Cl2生成KCl是被还原的过程,设溶液中ClO-与ClO3-的物质的量分别为x、y,
由被还原的氯原子与被氧化的氯原子的物质的量之比是4:1,可知被还原的Cl为4(x+y),
由电子守恒可知,x×(1-0)+y×(5-0)=4(x+y)×[0-(-1)],
解得x:y=1:3
溶液中ClO-与ClO3-的物质的量浓度之比为1:3,
故选A.
由被还原的氯原子与被氧化的氯原子的物质的量之比是4:1,可知被还原的Cl为4(x+y),
由电子守恒可知,x×(1-0)+y×(5-0)=4(x+y)×[0-(-1)],
解得x:y=1:3
溶液中ClO-与ClO3-的物质的量浓度之比为1:3,
故选A.
点评:本题考查氧化还原反应的计算,为高频考点,把握氧化还原反应中电子守恒为解答的关键,侧重分析能力与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
下列说法正确的是( )
| A、稀豆浆和雾均能产生丁达尔现象 |
| B、煤经气化和液化两个物理变化过程变为清洁能源 |
| C、海水是一个巨大的宝藏,如氯、溴、碘、硫、钠、钾等元素主要来自于海水 |
| D、PM2.5是指大气中直径小于或等于2.5微米的颗粒物.PM2.5比胶体粒子小,因其比表面积大,故可吸附含有铅、镉、铬、钒、砷等对人体有害的重金属离子,入肺后对人体产生很大的危害 |
下列变化过程中,需要加入还原剂的是( )
| A、HCl→H2 |
| B、FeCl2→FeCl3 |
| C、Na2SO3→SO2 |
| D、Fe→Fe3O4 |
下列离子方程式正确的是( )
| A、Al与NaOH溶液反应:2Al+2OH-+2H2O=2AlO2-+3H2↑ |
| B、FeBr2溶液中通入少量Cl2:2Fe2++2Br-+Cl2=2Fe3++Br2+2Cl- |
| C、稀硝酸除银镜:Ag+2H++NO3-=Ag++NO2↑+H2O |
| D、烧碱溶液中通入过量SO2:2OH-+SO2=SO32-+H2O |
有机物的命名是有规则的,下列有机物命名正确的是( )
| A、CH2=CH-CH=CH2 1,3-二丁烯 |
B、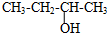 三丁醇 三丁醇 |
C、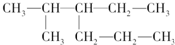 2甲基3丙基戊烷 2甲基3丙基戊烷 |
D、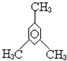 1,3,5-三甲基苯 1,3,5-三甲基苯 |
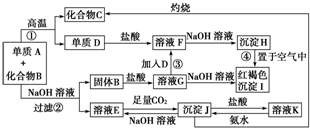
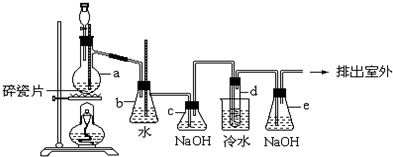
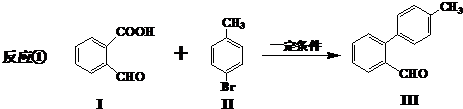
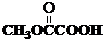 与
与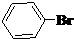 也可以发生类似反应①的反应,有机产物的结构简式为:
也可以发生类似反应①的反应,有机产物的结构简式为: