题目内容
由单质A和化合物B两种粉末组成的混合物,在一定条件下可按图所示关系进行转化(有些产物已略去):
请回答:
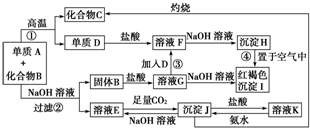
(1)A、B的化学式分别为 、 ;
(2)写出反应①的化学方程式 ;
(3)写出反应②的离子方程式 ;
(4)若要保存F溶液,应采取什么措施,为什么? .
请回答:

(1)A、B的化学式分别为
(2)写出反应①的化学方程式
(3)写出反应②的离子方程式
(4)若要保存F溶液,应采取什么措施,为什么?
考点:无机物的推断
专题:推断题
分析:解题的第一个“突破口”是红褐色沉淀I为〔Fe(OH)3〕,沉淀H置于空气中变成I,推出H为Fe(OH)2,再利用其他信息和逆向推理得出D为Fe,F为FeCl2,B为Fe2O3,G为FeCl3;第二个“突破口”是利用E、J、K之间的转化关系,结合有关知识和直觉判断E为NaAlO2,J为Al(OH)3,K为AlCl3,经进一步验证猜测成立,最后推出A为Al,B为Fe2O3,C为Al2O3,以此解答该题.
解答:
解:红褐色沉淀I为〔Fe(OH)3〕,沉淀H置于空气中变成I,推出H为Fe(OH)2,再利用其他信息和逆向推理得出D为Fe,F为FeCl2,B为Fe2O3,G为FeCl3;J既能与酸反应,又能与碱反应,则应为Al(OH)3,则E为NaAlO2,K为AlCl3,则单质A与化合物B两种粉末组成的混合物在高温下的反应应为铝热反应,推出A为Al,B为Fe2O3,C为Al2O3,
(1)由以上分析可知A为Al,B为Fe2O3,故答案为:Al;Fe2O3;
(2)反应①为Al和Fe2O3在高温下的铝热反应,反应的化学方程式为Fe2O3+2Al
Al2O3+2Fe,
故答案为:Fe2O3+2Al
Al2O3+2Fe;
(3)Al和Fe2O3混合物中,只有Al能和NaOH溶液反应,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)F为FeCl2,具有还原性,易被氧化,保存时应密闭保存,并加入铁屑防止被氧化,应水解呈碱性,可加入少量盐酸,抑制水解,
故答案为:在F溶液中加入少量铁粉,防止Fe2+被空气中的O2氧化;在F溶液中加入少量稀盐酸,抑制Fe2+水解.
(1)由以上分析可知A为Al,B为Fe2O3,故答案为:Al;Fe2O3;
(2)反应①为Al和Fe2O3在高温下的铝热反应,反应的化学方程式为Fe2O3+2Al
| ||
故答案为:Fe2O3+2Al
| ||
(3)Al和Fe2O3混合物中,只有Al能和NaOH溶液反应,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)F为FeCl2,具有还原性,易被氧化,保存时应密闭保存,并加入铁屑防止被氧化,应水解呈碱性,可加入少量盐酸,抑制水解,
故答案为:在F溶液中加入少量铁粉,防止Fe2+被空气中的O2氧化;在F溶液中加入少量稀盐酸,抑制Fe2+水解.
点评:本题考查无机物的推断,为高频考点,侧重于学生的分析能力的考查,题目难度中等,本题注意把握信息中的题眼,为解答该题的关键.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案
相关题目
下列关于有机物的叙述正确的是( )
| A、石油的分馏和裂化均属于化学变化 |
| B、乙醇、乙酸能用碳酸钠溶液、紫色石蕊溶液、酸性高锰酸钾溶液等多种方法鉴别 |
| C、2-丙醇在NaOH的醇溶液里共热可生成丙烯是发生消去反应 |
| D、因为葡萄糖在糖类结构中最简单,因此它是一种单糖 |
若2g甲烷含有m个分子,则阿伏加德罗常数为( )
A、
| ||
| B、16m | ||
| C、32m | ||
| D、8m |
10mL某气态烃在80mL O2中充分燃烧,得到液态水和体积为65mL的混合气体(气体体积均在相同条件下测定),该气态烃不可能是( )
| A、丙烷 | B、乙烷 | C、丙烯 | D、丁炔 |
下列有机物命名正确的是( )
A、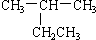 2-乙基丙烷 2-乙基丙烷 |
B、 1,2-二溴乙烷 1,2-二溴乙烷 |
C、 间二甲苯 间二甲苯 |
D、 2-甲基-2-丙烯 2-甲基-2-丙烯 |



