题目内容
依据题目要求回答下列问题。
(1)常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如表所示。
①上述盐溶液中的阴离子结合H+能力最强的是 。
②根据表中数据,浓度均为0.01 mol·L-1的下列五种物质的溶液中,酸性最强的是 (填字母编号,下同);将各溶液分别稀释100倍,pH变化最小的是 。
A.HCN B.HClO C.C6H5OH D.CH3COOH E.H2CO3
③根据上表数据,请你判断下列反应不能成立的是 。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+NaClO=NaHCO3+HClO
D.CO2+H2O+2C6H5Ona=Na2CO3+2C6H5OH
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸氢钠溶液,反应的离子方程式为 。
(2)已知常温下Cu(OH)2的Ksp=2×10-20。又知常温下某CuSO4溶液中c(Cu2+)="0.02" mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液的pH大于 。
(1)常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如表所示。
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
②根据表中数据,浓度均为0.01 mol·L-1的下列五种物质的溶液中,酸性最强的是 (填字母编号,下同);将各溶液分别稀释100倍,pH变化最小的是 。
A.HCN B.HClO C.C6H5OH D.CH3COOH E.H2CO3
③根据上表数据,请你判断下列反应不能成立的是 。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+NaClO=NaHCO3+HClO
D.CO2+H2O+2C6H5Ona=Na2CO3+2C6H5OH
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸氢钠溶液,反应的离子方程式为 。
(2)已知常温下Cu(OH)2的Ksp=2×10-20。又知常温下某CuSO4溶液中c(Cu2+)="0.02" mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液的pH大于 。
(1)①C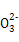 ②D C ③D
②D C ③D
④Cl2+HC
 CO2+Cl-+HClO(分步写成Cl2+H2O
CO2+Cl-+HClO(分步写成Cl2+H2O HClO+H++Cl-,H++HC
HClO+H++Cl-,H++HC
 CO2↑+H2O也可)
CO2↑+H2O也可)
(2)5
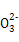 ②D C ③D
②D C ③D④Cl2+HC

 CO2+Cl-+HClO(分步写成Cl2+H2O
CO2+Cl-+HClO(分步写成Cl2+H2O HClO+H++Cl-,H++HC
HClO+H++Cl-,H++HC
 CO2↑+H2O也可)
CO2↑+H2O也可)(2)5
(1)①根据“酸越弱,其酸根离子水解程度越大”理论由Na2CO3溶液的pH最大,可知C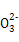 的水解能力最强,所以C
的水解能力最强,所以C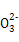 结合H+的能力最强。②等物质的量浓度的NaCN、NaClO、C6H5ONa、CH3COONa、NaHCO3溶液,CH3COONa溶液的pH最小,CH3COONa的水解能力最弱,CH3COOH的酸性最强,C6H5OH的酸性最弱,C6H5OH电离能力最弱,稀释过程中溶液的pH变化也最小。③C6H5ONa溶液中通入CO2时生成的物质应该是NaHCO3而不是Na2CO3。
结合H+的能力最强。②等物质的量浓度的NaCN、NaClO、C6H5ONa、CH3COONa、NaHCO3溶液,CH3COONa溶液的pH最小,CH3COONa的水解能力最弱,CH3COOH的酸性最强,C6H5OH的酸性最弱,C6H5OH电离能力最弱,稀释过程中溶液的pH变化也最小。③C6H5ONa溶液中通入CO2时生成的物质应该是NaHCO3而不是Na2CO3。
(2)Ksp[Cu(OH)2]=c(Cu2+)·c2(OH-)=2×10-20=0.02×c2(OH-),解得c(OH-)=10-9 mol·L-1,要使Cu2+生成Cu(OH)2沉淀,则c(OH-)>10-9 mol·L-1,溶液的pH>5。
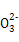 的水解能力最强,所以C
的水解能力最强,所以C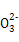 结合H+的能力最强。②等物质的量浓度的NaCN、NaClO、C6H5ONa、CH3COONa、NaHCO3溶液,CH3COONa溶液的pH最小,CH3COONa的水解能力最弱,CH3COOH的酸性最强,C6H5OH的酸性最弱,C6H5OH电离能力最弱,稀释过程中溶液的pH变化也最小。③C6H5ONa溶液中通入CO2时生成的物质应该是NaHCO3而不是Na2CO3。
结合H+的能力最强。②等物质的量浓度的NaCN、NaClO、C6H5ONa、CH3COONa、NaHCO3溶液,CH3COONa溶液的pH最小,CH3COONa的水解能力最弱,CH3COOH的酸性最强,C6H5OH的酸性最弱,C6H5OH电离能力最弱,稀释过程中溶液的pH变化也最小。③C6H5ONa溶液中通入CO2时生成的物质应该是NaHCO3而不是Na2CO3。(2)Ksp[Cu(OH)2]=c(Cu2+)·c2(OH-)=2×10-20=0.02×c2(OH-),解得c(OH-)=10-9 mol·L-1,要使Cu2+生成Cu(OH)2沉淀,则c(OH-)>10-9 mol·L-1,溶液的pH>5。

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目