题目内容
17.下列电离方程式书写错误的是( )| A. | NaHCO3═Na++HCO3- | B. | Cu(NH3)4SO4═Cu2++4NH3+SO42- | ||
| C. | NH3•H2O?NH4++OH- | D. | KAl(SO4)2═K++Al3++2SO42- |
分析 强电解质在溶液中能完全电离,弱电解质则部分电离,离子团在电离方程式中不能拆开.
解答 解:A、碳酸氢钠是强电解质,能完全电离出钠离子和碳酸氢根离子,碳酸氢根离子团不能拆开,即NaHCO3=Na++HCO3-,故A正确;
B、Cu(NH3)4SO4是络合物,电离方程式为:Cu(NH3)4SO4═[Cu(NH3)4]2++SO42-,故B错误;
C、一水合氨是弱碱,不完全电离,即NH3•H2O?NH4++OH-,故B正确;
D、硫酸铝钾属于强电解质,能完全电离出铝离子、钾离子和硫酸根离子,故D正确.
故选B.
点评 本题考查学生电离方程式的书写知识,可以根据所学知识进行回答,较简单.

练习册系列答案
相关题目
7.(一)按要求作答:
(1)第四周期中,未成对电子数最多的原子,其外围电子排布式为:3d54s1.
(2)3d能级为半充满的正三价离子,该离子的电子排布式为1s22s22p63s23p63d5.
(二)A、B、C、D、E五种元素为1~18号元素.已知:它们的原子序数依次增大,A、B两种元素的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2;C元素原子的电子层数及最外层电子数都比E元素的少1;D和E的原子序数之和为30.它们两两形成的化合物有甲、乙、丙、丁四种.这四种化合物中原子个数比如下表:
(1)E-的结构示意图是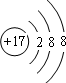 .B原子核外有2个未成对电子,它们的能量相等(填“相等”或“不相等”).
.B原子核外有2个未成对电子,它们的能量相等(填“相等”或“不相等”).
(2)向甲的水溶液中加入MnO2可用于实验室制备C的单质,其化学方程式是2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
(3)已知有机物乙的分子为平面结构,键角都为120°,它的结构简式为CH2=CH2.
(4)丙的水溶液呈酸性,与饱和NaHCO3溶液反应会产生大量的气体和难溶物,有关离子方程式是Al3++3HCO3-=Al(OH)3↓+3CO2↑.
(1)第四周期中,未成对电子数最多的原子,其外围电子排布式为:3d54s1.
(2)3d能级为半充满的正三价离子,该离子的电子排布式为1s22s22p63s23p63d5.
(二)A、B、C、D、E五种元素为1~18号元素.已知:它们的原子序数依次增大,A、B两种元素的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2;C元素原子的电子层数及最外层电子数都比E元素的少1;D和E的原子序数之和为30.它们两两形成的化合物有甲、乙、丙、丁四种.这四种化合物中原子个数比如下表:
| 甲 | 乙 | 丙 | 丁 | |
| 化合物中各元素原子个数比 | A和C 1:1 | B和A 1:2 | D和E 1:3 | B和E 1:4 |
 .B原子核外有2个未成对电子,它们的能量相等(填“相等”或“不相等”).
.B原子核外有2个未成对电子,它们的能量相等(填“相等”或“不相等”).(2)向甲的水溶液中加入MnO2可用于实验室制备C的单质,其化学方程式是2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
(3)已知有机物乙的分子为平面结构,键角都为120°,它的结构简式为CH2=CH2.
(4)丙的水溶液呈酸性,与饱和NaHCO3溶液反应会产生大量的气体和难溶物,有关离子方程式是Al3++3HCO3-=Al(OH)3↓+3CO2↑.
8.下列溶液中,能大量共存的离子组是( )
| A. | Ba2+、Cu2+、C1-、NO3- | B. | Ca2+、Al3+、Br-、ClO- | ||
| C. | NH4+、K+、HSO3-、CO32- | D. | Na+、K+、MnO4-、I- |
5.(1)相同体积、相同物质的量浓度的AgNO3溶液,分别与相同体积的KCl、CuCl2、AlCl3溶液反应恰好完全反应,则KCl、CuCl2、AlCl3三种溶液的物质的量浓度之为6:3:2.
(2)M(NO3)2热分解化学方程式为2M(NO3)2═2MO+4NO2↑+O2↑,加热29.6g M(NO3)2使其完全分解,在标准状况下收集11.2L的气体,那么M的摩尔质量是40g/mol.
(3)现有一种铜和氧化亚铁的混合物样品.为测定该样品中氧化亚铁的含量,某学生
取20.0g此样品置于烧杯中,分四次加入密度为1.22g/cm3的硫酸并作相关记录.有关数据记录如下表:
试计算:①10.0g此样品中铜的物质的量0.0625mol.②样品中氧化亚铁的质量分数60%.③所用硫酸溶液溶质的物质的是浓度2.8mol/l.
(4)液态CS2能够在O2中燃烧生成CO2和SO2两种气体,今用0.228g CS2在448mL氧气(标准状况)中完全燃烧,反应后混合气体的平均摩尔质量是43.4g/mol.
(2)M(NO3)2热分解化学方程式为2M(NO3)2═2MO+4NO2↑+O2↑,加热29.6g M(NO3)2使其完全分解,在标准状况下收集11.2L的气体,那么M的摩尔质量是40g/mol.
(3)现有一种铜和氧化亚铁的混合物样品.为测定该样品中氧化亚铁的含量,某学生
取20.0g此样品置于烧杯中,分四次加入密度为1.22g/cm3的硫酸并作相关记录.有关数据记录如下表:
| 加硫酸的序号 | 加硫酸的体积/mL | 剩余固体的质量/g |
| 1 | 20.0 | 16.0 |
| 2 | 20.0 | 12.0 |
| 3 | 20.0 | 8.0 |
| 4 | 20.0 | 8.0 |
(4)液态CS2能够在O2中燃烧生成CO2和SO2两种气体,今用0.228g CS2在448mL氧气(标准状况)中完全燃烧,反应后混合气体的平均摩尔质量是43.4g/mol.
12.下列物质中,属于非电解质的是( )
| A. | 硝酸钾 | B. | 氨水 | C. | 酒精 | D. | 铜 |
2.下列说法正确的是( )
| A. | 电离时生成的阳离子全部是氢离子的化合物叫做酸 | |
| B. | CO2的水溶液可以导电,所以CO2是电解质 | |
| C. | 所有盐均电离出金属阳离子和酸根离子 | |
| D. | 强电解质的溶液导电能力强于弱电解质的溶液 |
9.下列关于氧化还原反应的叙述中,正确的是( )
| A. | 有单质参加的反应一定是氧化还原反应 | |
| B. | 一种物质被氧化,必有另一种物质被还原 | |
| C. | 2Fe+3Cl2═2FeCl3; Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS 由此可以判断氧化性:Cl2>S | |
| D. | Mg在化学反应中失去2个电子,而Al在化学反应中失去3个电子,因此还原性Al>Mg |
6.能说明苯分子的平面正六边形的结构中,碳碳键不是单、双键交替的事实是( )
| A. | 溴苯没有同分异构体 | B. | 苯能与氢气加成得到环己烷 | ||
| C. | 间二甲苯只有一种 | D. | 邻二甲苯只有一种结构 |
7.下列离子方程式,正确的是( )
| A. | 氢氧化铁与盐酸反应:H++OH-═H2O | |
| B. | 过量NaHSO4溶液与少量Ba(OH)2溶液反应:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| C. | 铁与盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | CaCO3溶于稀盐酸中:CO32-+2H+═CO2↑+H2O |