题目内容
(14分)工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:
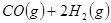


(1)判断反应达到平衡状态的依据是(填字母序号,下同)__________。
A. 生成 的速率与消耗
的速率与消耗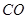 的速率相等
的速率相等
B. 混合气体的密度不变
C. 混合气体的相对平均分子质量不变
D.  、
、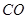 、
、 的浓度都不再发生变化
的浓度都不再发生变化
E. 气体的压强不再改变
(2)下表所列数据是反应在不同温度下的化学平衡常数(K)。
|
温度 |
250℃ |
300℃ |
350℃ |
|
K |
2.041 |
0.270 |
0.012 |
①由表中数据判断该反应的△H__________0(填“>”、“=”或“<”);
②某温度下,将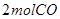 和
和 充入
充入 的密闭容器中,充分反应后,达到平衡时测得
的密闭容器中,充分反应后,达到平衡时测得 ,则CO的转化率为__________,此时的温度为__________。
,则CO的转化率为__________,此时的温度为__________。
(3)要提高CO的转化率,可以采取的措施是__________。
a. 升温 b. 加入催化剂 c. 增加CO的浓度
d. 恒容下加入 使压强变大 e. 恒容下加入惰性气体使压强变大 f. 分离出甲醇
使压强变大 e. 恒容下加入惰性气体使压强变大 f. 分离出甲醇
(4)在250℃时,某时刻测得该温度下的密闭容器中各物质的物质的量浓度见下表:
|
CO |
|
|
|
0.5 mol·L—1 |
2mol·L—1 |
6mol·L—1 |
此时反应的正、逆反应速率的关系是:v(正) v(逆)(填“大于”“小于”或“等于”)。
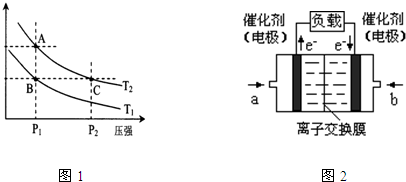
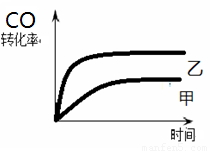
(5)如图1所示,甲为恒容密闭容器,乙为恒压密闭容器。在甲、乙两容器中分别充入等物质的量的H2和CO,使甲、乙两容器初始容积相等。在相同温度下发生上述反应,并维持反应过程中温度不变。已知甲容器中CO的转化率随时间变化的图像如图2所示,请在图2中画出乙容器中CO的转化率随时间变化的图像。

(1)CDE(2分)
(2)①<(2分)②80%
(2分)250℃(2分)
(3)df(2分)
(4)小于(2分)
(5)(2分)
【解析】(1)A中的速率方向是相同的,不能说明。混合气的密度是混合气的质量和容器容积的比值,在反应过程中,均是不变的,即混合气的密度也是不变的。混合气体的相对平均分子质量是混合气的质量和混合气总的物质的量的比值,质量不变,氮总的物质的量是变化的,所以当混合气体的相对平均分子质量不变时可以说明。浓度不再发生变化,就说明正逆反应速率相等,可以说明。反应前后体积变化,所以压强在反应过程中是变化的,E可以说明。
(2)升高温度,平衡常数减小,说明反应向逆反应方向移动,即正反应是放热反应,△H小于0。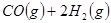


起始量(mol) 2 6 0
转化量(mol) 1.6 3.2 1.6
平衡量(mol) 0.4 2.8 1.6
所以CO的转化率是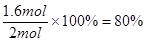
平衡常数为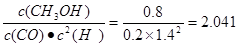
所以温度是250℃
(3)因为反应是体积增大的、放热的可逆反应,所以升高温度平衡向逆反应方向移动,转化率降低。催化剂不能影响平衡,转化率不变。增加CO的浓度,平衡向正反应方向移动,但CO的转化率降低。增大氢气浓度,平衡向正反应方向移动,CO的转化率增大。恒容下加入惰性气体使压强变大,但反应物的浓度并没有变化,平衡不移动,转化率不变。分离出甲醇,平衡向正反应方向移动,CO的转化率增大。答案选df。
(4)此时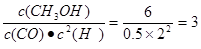 >2.041,所以反应选逆反应方向移动,即正反应速率小于逆反应速率。
>2.041,所以反应选逆反应方向移动,即正反应速率小于逆反应速率。
(5)反应是体积减小的可逆反应,所以在反应过程中,加中压强减小,而乙中压强是不变的。压强大,反应速率快,到达平衡的时间短、压强大,有利于平衡向正反应方向移动,CO的转化率大,所以图像为 。
。

 名校课堂系列答案
名校课堂系列答案 CH3OH(g)△H
CH3OH(g)△H