题目内容
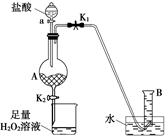
海藻中含有丰富的碘元素(以I-形式存在)。实验室中提取碘的流程如下: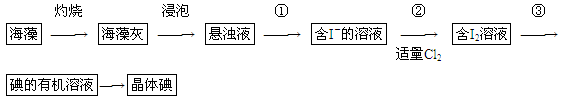 (1)实验操作③的名称是________,所用主要仪器名称为________。
(1)实验操作③的名称是________,所用主要仪器名称为________。
(2)提取碘的过程中,可供选择的有机试剂是________(填序号)。
A.酒精(沸点78℃) B.四氯化碳(沸点77℃)
C.甘油(沸点290℃) D.苯(沸点80℃)
(3)在操作②中,溶液中生成少量ICl(ICl的性质类似于氯气),为消除此杂质,使碘全部游离出来,应加入适量(填序号)________溶液,反应的离子方程式______________________。
A.KIO3 B.HClO C.KI D.Br2
(4)利用碘的有机溶液得到单质I2的方法是_______________________________________。
(1)萃取、分液 分液漏斗 (2)BD (3)C ICl+I-=I2+Cl- (4)蒸馏法
解析

 全优点练单元计划系列答案
全优点练单元计划系列答案已知某酸性土壤浸取液中除Fe3+外,还含有一定量Mg2+和Al3+。请设计合理实验检验该浸取液中的Mg2+、Al3+。
限选实验用品与试剂;烧杯、试管、玻璃棒、滴管、玻璃片、pH试纸;浸取液、20%KSCN、0.1 mol·L-1 NaOH、6 mol·L-1 NaOH、0.1 mol·L-1 HCl、蒸馏水。
必要时可参考:
| 沉淀物 | 开始沉淀时的pH | 沉淀完全时的pH |
| Mg(OH)2 | 9.6 | 11.1 |
| Fe(OH)3 | 2.7 | 3.7 |
根据你设计的实验方案,叙述实验操作、预期现象和结论。(测定溶液pH的具体操作可不写)
| 实验操作 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: | |
| 步骤3: | |
| …… | |
过氧化尿素是一种新型漂白、消毒剂,漂白、消毒效果优于H2O2和过氧乙酸,某工业用过氧化尿素的部分参数列于下表。
| 分子式 | 外观 | 热分解温度 | 熔点 | 水溶性(20℃) |
| CO(NH2)2·H2O2 | 白色晶体 | 45℃ | 75—85℃ | 500g·L—1 |
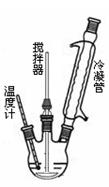
合成过氧化尿素的流程及反应器的示意图如下:

请回答下列问题:
(1)写出合成过氧化尿素的化学方程式: 。
(2)反应器里冷凝管中冷水从 (填“上”或“下”)口流入;反应器的加热方式是 。
①直接加热;②水浴加热;③蒸气浴加热;④冰浴
(3)搅拌器选用的材料是玻璃而不是铁质或铝质材料的原因是 ,
(4)从母液中分离出H2O2和尿素,采用的是减压蒸发、冷却结晶的方法,其原因是 。
(5)活性氧含量的高低直接决定产品的质量,合格产品中活性氧的含量≥16%(相当于其中含H2O234%)。为了确定所得产品合格与否,质检员称取干燥样品2.000g,溶解于水,在250mL容量瓶中定容,准确量取其中25.00mL溶液于锥形瓶中,加入1mL 6mol/LH2SO4,然后用0.1000mol/L KMnO4标准溶液滴定样品中的H2O2(KMnO4溶液不与尿素反应),至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液6.000mL:
完成并配平下列化学方程式:
MnO4—+ H2O2+ H+= Mn2++ H2O+

②KMnO4溶液应盛放在 滴定管中,若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量 (填“偏高”、“偏低”或“不变”);
③根据滴定结果确定产品质量 (填“合格”或“不合格”),活性氧的质量分数为 。
K3[Fe(C2O4)3]·3H2O [三草酸合铁(Ⅲ)酸钾晶体]易溶于水,难溶于乙醇,可作为有机反应的催化剂。实验室可用废铁屑等物质为原料制备,并测定产品的纯度。相关反应的化学方程式为:Fe + H2SO4 =FeSO4 + H2↑ FeSO4+H2C2O4+2H2O=FeC2O4·2H2O↓+H2SO4
2FeC2O4·2H2O+H2O2+H2C2O4+3K2C2O4=2K3[Fe(C2O4)3]+6H2O
回答下列问题:
(1)使用废铁屑前,往往将其在1.0mol.L-1Na2CO3溶液中浸泡数分钟,其目的是 。然后使用 (填写操作名称)分离并洗涤铁屑。
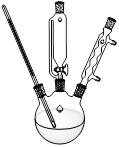
(2)析出的K3[Fe(C2O4)3]·3H2O晶体可通过如下图所示装置通过减压过滤与母液分离。下列关于减压过滤的操作正确的是 。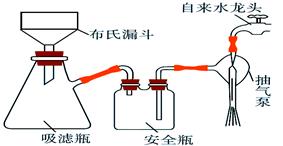
| A.选择比布氏漏斗内径略小又能将全部小孔盖住的滤纸 |
| B.放入滤纸后,直接用倾析法转移溶液和沉淀,再打开水龙头抽滤 |
| C.洗涤晶体时,先关闭水龙头,用蒸馏水缓慢淋洗,再打开水龙头抽滤 |
| D.抽滤完毕时,应先断开抽气泵和吸滤瓶之间的橡皮管,以防倒吸 |
(4)某同学称取2.000g产品,经预处理后配制成100mL溶液,移取25.00mL溶液于锥形瓶中,使用0.03000 mol·L-1KMnO4标准溶液滴定,消耗标准溶液10.00mL。
①实际进行滴定时,往往使用酸化的KMnO4标准溶液,写出该滴定反应的离子方程式 。
②判断到达滴定终点的现象是 。
③该产品的纯度为 ﹪(保留四位有效数字)。
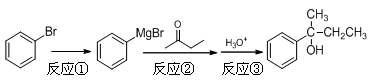
实验室合成环己酮的反应、装置示意图及有关数据如下: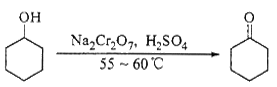
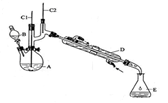
环己醇、环己酮、饱和食盐水和水的部分物理性质见下表:
| 物质 | 沸点(℃) | 密度(g·cm-3, 20℃) | 溶解性 |
| 环己醇 | 161.1(97.8) | 0.9624 | 能溶于水 |
| 环己酮 | 155.6(95) | 0.9478 | 微溶于水 |
| 饱和食盐水 | 108.0 | 1.3301 | |
| 水 | 100.0 | 0.9982 | |
括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点
(1)酸性Na2Cr2O7溶液氧化环己醇反应的ΔH<0,反应剧烈将导致体系温度迅速上升,副反应增多。实验中通过装置B将酸性Na2Cr2O7溶液加到盛有环己醇的A中,在55~60℃进行反应。反应完成后,加入适量水,蒸馏,收集95 ~ 100℃的馏分,得到主要含环己酮粗品和水的混合物。
①如何滴加酸性Na2Cr2O7溶液 ,用漂粉精和冰醋酸代替酸性Na2Cr2O7溶液也可氧化环己醇制环己酮,用漂粉精和冰醋酸氧化突出的优点是 。
②蒸馏不能分离环己酮和水的原因是 。
(2)环己酮的提纯需要经过以下一系列的操作:a.蒸馏,收集151~ 156℃馏分,b.过滤,c.在收集到的馏分中加NaCl固体至饱和,静置,分液,d.加入无水MgSO4固体,除去有机物中少量水。
①上述操作的正确顺序是 (填字母)。
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有 。
③在上述操作c中,加入NaCl固体的作用是 。
(3)利用核磁共振氢谱可以鉴定制备的产物是否为环己酮,环己酮分子中有 种不同化学环境的氢原子。
浅绿色的硫酸亚铁铵晶体[又名莫尔盐,(NH4)2SO4·FeSO4·6H2O]比绿矾(FeSO4·7H2O)更稳定,常用于定量分析。莫尔盐的一种实验室制法如下:
废铁屑
 溶液A
溶液A

 莫尔盐
莫尔盐
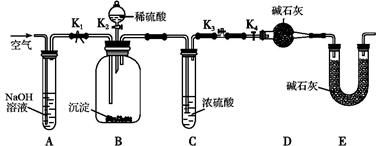
(1)向废铁屑中加入稀硫酸后,不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是 ;证明溶液A不含Fe3+的最佳试剂是 (填序号字母)。
| A.酚酞溶液 | B.KSCN溶液 |
| C.烧碱溶液 | D.KMnO4溶液 |
(2)操作Ⅰ得到的莫尔盐晶体用少量乙醇淋洗,其目的是:①除去晶体表面附着的硫酸、水等杂质;② 。
(3)用托盘天平称量(NH4)2SO4晶体,晶体要放在天平 (填“左”或“右”)盘。
(4)从下列装置中选取必要的装置制取(NH4)2SO4溶液,连接的顺序(用接口序号字母表示)是:a接 ; 接 。
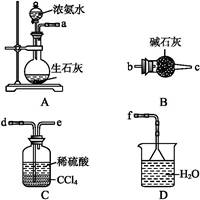
将装置C中两种液体分离开的操作名称是 。装置D的作用是 。