题目内容
(12分)
(1)下图所示是实验室中制取气体的一种简易装置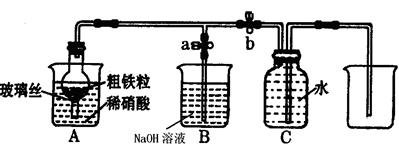
①.甲同学用下列方法检验发生装置的气密性,请问能否达到目的 (填能或否)
关闭止水夹a和b,从A处烧杯中加入水,使干燥管与烧杯中液面形成液面差,一段时间后,液面差没有变化,说明气密性良好。
②.实验室利用上图所示发生装置可以制取下列 气体。
| A.Cl2 | B.CO2 | C.NH3 | D.SO2 |
①NO气体能用排水法收集,而不能用排空气法收集的原因是 。
②制取NO时,向A杯中加入稀硝酸,同时打开止水夹a,关闭止水夹b,A装置的干燥管中观察到气体的颜色的变化为 。
B装置烧杯中NaOH溶液的作用是 。当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体。
③将a mol铁与含b molHNO3的稀溶液充分反应后,若HNO3的还原产物只有NO,反
应后Fe和HNO3均无剩余,则反应中转移电子的物质的量为 mol(用含b的代数式示)。
(1)①能 (2分) ②B (2分)
(2)①NO与空气中的O2反应;(2分)
②红棕色,(2分) ; 吸收NOx (2分),; ③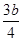 mol (2分)
mol (2分)
解析

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
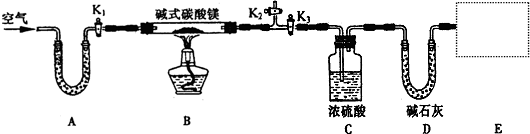
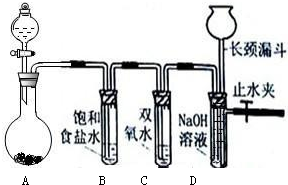
 下面是中学化学中常用玻璃仪器组成的实验装置图(根据需要可在其中加入液体或固体).
下面是中学化学中常用玻璃仪器组成的实验装置图(根据需要可在其中加入液体或固体).