题目内容
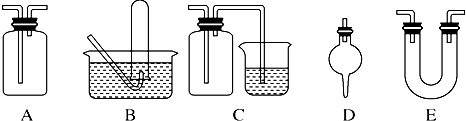
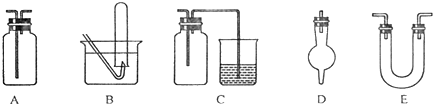
 下面是中学化学中常用玻璃仪器组成的实验装置图(根据需要可在其中加入液体或固体).
下面是中学化学中常用玻璃仪器组成的实验装置图(根据需要可在其中加入液体或固体).请回答下列问题:
(1)能用作干燥氨气的装置有
D、E
D、E
(填字母);(2)既能用于收集氯气又能用于收集一氧化氮气体的装置有
B
B
(填字母);(3)在氯气和铁反应实验中,能添加在制氯气和反应装置之间以除去氯气中氯化氢等杂质气体的装置有
A
A
(填字母);(4)能用于乙烯与溴水反应制二溴乙烷的实验装置有
A
A
(填字母);(5)若用C装置作二氧化硫与烧杯中氢氧化钠溶液反应的实验,则其中广口瓶的作用是
防止倒吸
防止倒吸
.(6)为比较Fe3+和Cu2+对H2O2分解的催化效果,某同学设计了下图所示的实验.

①可通过观察
根据2H2O2
2H2O+O2↑可知以生成气体的快慢来判断反应的快慢
| ||
根据2H2O2
2H2O+O2↑可知以生成气体的快慢来判断反应的快慢
现象来定性比较得出结论.
| ||
②有同学提出将CuSO4改为CuCl2更为合理,其理由是
由于CuSO4、FeCl3中的阴离子不同,不能排除阴离子的因素
由于CuSO4、FeCl3中的阴离子不同,不能排除阴离子的因素
,你认为还可以作何改进?将FeCl3改为Fe2(SO4)3
将FeCl3改为Fe2(SO4)3
﹒分析:(1)氨气为碱性气体,常用碱性干燥剂碱石灰固体干燥,以此选择所用仪器;
(2)一氧化氮易与氧气反应,只能用排水法收集;
(3)除去氯气中氯化氢等杂质气体的装置应为洗气瓶,只有A可以;
(4)乙烯与溴水反应制二溴乙烷的实验为气体和液体的反应,所用仪器具有双孔橡皮塞;
(5)二氧化硫气体极易溶于水,要防止倒吸;
(6)①比较反应速率的大小可通过生成气体的快慢来判断;
②比较不同催化剂的催化效果,应排除其它因素的干扰;
(2)一氧化氮易与氧气反应,只能用排水法收集;
(3)除去氯气中氯化氢等杂质气体的装置应为洗气瓶,只有A可以;
(4)乙烯与溴水反应制二溴乙烷的实验为气体和液体的反应,所用仪器具有双孔橡皮塞;
(5)二氧化硫气体极易溶于水,要防止倒吸;
(6)①比较反应速率的大小可通过生成气体的快慢来判断;
②比较不同催化剂的催化效果,应排除其它因素的干扰;
解答:解:(1)氨气为碱性气体,常用碱性干燥剂碱石灰固体干燥,而碱石灰只能填装在D、E中,故答案为:D、E;
(2)一氧化氮易与氧气反应,只能用排水法收集,只能用B,故答案为:B;
(3)除去氯气中氯化氢等杂质气体的装置应为洗气瓶,A长用作洗气瓶,故答案为:A;
(4)A装置可用作乙烯与溴水反应制二溴乙烷的实验装置,乙烯从长导管进入,瓶中装有溴水,故答案为:A;
(5)二氧化硫气体极易溶于水,要防止倒吸,C集气瓶起到安全瓶的作用,故答案为:防止倒吸;
(6)①比较反应速率的大小可通过生成气体的快慢来判断,故答案为:根据2H2O2
2H2O+O2↑可知以生成气体的快慢来判断反应的快慢;
②比较不同催化剂的催化效果,应排除其它因素的干扰,故答案为:由于CuSO4、FeCl3中的阴离子不同,不能排除阴离子的因素;将FeCl3改为Fe2(SO4)3.
(2)一氧化氮易与氧气反应,只能用排水法收集,只能用B,故答案为:B;
(3)除去氯气中氯化氢等杂质气体的装置应为洗气瓶,A长用作洗气瓶,故答案为:A;
(4)A装置可用作乙烯与溴水反应制二溴乙烷的实验装置,乙烯从长导管进入,瓶中装有溴水,故答案为:A;
(5)二氧化硫气体极易溶于水,要防止倒吸,C集气瓶起到安全瓶的作用,故答案为:防止倒吸;
(6)①比较反应速率的大小可通过生成气体的快慢来判断,故答案为:根据2H2O2
| ||
②比较不同催化剂的催化效果,应排除其它因素的干扰,故答案为:由于CuSO4、FeCl3中的阴离子不同,不能排除阴离子的因素;将FeCl3改为Fe2(SO4)3.
点评:本题考查常见化学仪器的使用,涉及气体的净化、收集实验安全、实验探究的等问题,题目难度不大,注意A瓶,可用作集气瓶、洗气瓶、安全瓶、量器瓶等.

练习册系列答案
相关题目

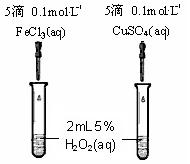 (4)为比较Fe3+和Cu2+对H2O2分解的催化效果,某同学设计了右图所示的实验。
(4)为比较Fe3+和Cu2+对H2O2分解的催化效果,某同学设计了右图所示的实验。