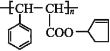题目内容
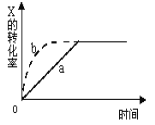
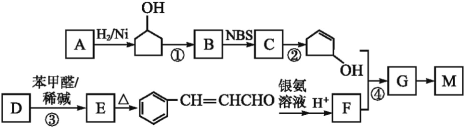
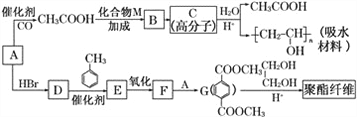
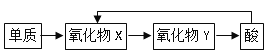
【题目】甲、乙、丙、丁、戊五种物质是中学化学常见的物质,其中甲、乙均为单质,它们的转化关系如图所示![]() 某些条件和部分产物已略去
某些条件和部分产物已略去![]() 。下列说法正确的是
。下列说法正确的是
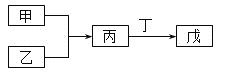
A.若甲可以与NaOH溶液反应放出H2,则丙一定是两性氧化物
B.若甲为短周期中最活泼的金属,且戊为碱,则丙生成戊一定是氧化还原反应
C.若丙、丁混合产生大量白烟,则乙可能具有漂白性
D.若甲、丙、戊都含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为甲![]() 丙
丙![]() 戊
戊
【答案】D
【解析】
A.甲为单质,若甲可以与NaOH溶液反应放出![]() ,则甲为Al或Si,所以丙可能是氧化铝,也可能是二氧化硅,不一定是两性氧化物,故A错误;
,则甲为Al或Si,所以丙可能是氧化铝,也可能是二氧化硅,不一定是两性氧化物,故A错误;
B.若甲为短周期中最活泼的金属,且戊为碱,则甲为Na,乙为氧气,所以丙可以为氧化钠或过氧化钠,当丙为氧化钠时,丙生成戊不是氧化还原反应,故B错误;
C.丙、丁混合产生白烟,则丙、丁可为HCl和![]() 或
或![]() 和
和![]() 等,甲、乙均为单质,则乙可能是氯气或氢气或氮气,都不具有漂白性,故C错误;
等,甲、乙均为单质,则乙可能是氯气或氢气或氮气,都不具有漂白性,故C错误;
D.若甲、丙、戊含有同一种元素,当甲为S,乙为氧气,丙为二氧化硫,丁为HClO等具有强氧化性的物质,戊为硫酸,则含S元素的化合价由低到高的顺序为甲![]() 丙
丙![]() 戊,故D正确;
戊,故D正确;
故答案为D。

【题目】按要求回答下列问题:
(1)实验室中通常用NaOH溶液进行洗气和提纯,当用100mL3mol·L-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为__。
(2)常温下,向一定体积的0.1mol·L-1的醋酸溶液中加水稀释后,下列说法正确的是__(填字母)。
A.溶液中导电粒子的数目减少
B.醋酸的电离程度增大,c(H+)也增大
C.溶液中![]() 不变
不变
D.溶液中![]() 减小
减小
(3)①常温下将0.15mol·L-1的稀硫酸V1mL与0.1mol·L-1的NaOH溶液V2mL混合,所得溶液的pH为1,则V1∶V2=__(溶液体积的变化忽略不计)。
②常温下若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得,则下列说法正确的是__(填字母)。
A.若混合后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol·L-1
B.若V1=V2,混合后溶液的pH一定等于7
C.若混合后溶液呈酸性,则V1一定大于V2
D.若混合后溶液呈碱性,则V1一定小于V2
(4)常温下,浓度均为0.1mol·L-1的下列五种溶液的pH如表所示:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①根据表中数据,将浓度均为0.01mol·L-1的下列四种酸的溶液分别稀释100倍,pH变化最小的是__(填字母)。
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是__(填字母)。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.NaHCO3+HCN=NaCN+H2O+CO2↑
(5)几种离子开始沉淀时的pH如表所示:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度Cu2+、Mg2+和Fe2+的溶液中滴加NaOH溶液时,__(填离子符号)先沉淀。