题目内容
(选做题)(10分)在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)常温下,将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是____
A.c(HA)<c(A-) B.c(HA)一定大于0.1mol/L
C.c(Na+)=c(HA)+c(A-) D.2c(OH-)=2c(H+)+[c(HA)-c(A-)]
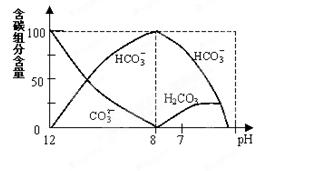
(2)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液中含碳元素的各种微粒(CO2逸出未画)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32-(填:“能”或“不能”) 大量共存。
②当pH=7时,溶液中各种离子其物质的量浓度的大小关系是:
。
③已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh=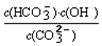 =2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH= 。
=2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH= 。
(1)常温下,将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是____
A.c(HA)<c(A-) B.c(HA)一定大于0.1mol/L
C.c(Na+)=c(HA)+c(A-) D.2c(OH-)=2c(H+)+[c(HA)-c(A-)]
(2)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液中含碳元素的各种微粒(CO2逸出未画)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。

回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32-(填:“能”或“不能”) 大量共存。
②当pH=7时,溶液中各种离子其物质的量浓度的大小关系是:
。
③已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh=
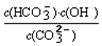 =2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH= 。
=2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH= 。(1)D,(2)不能 ②c(Na+)>c(Cl-)>c(HCO3-)>c(H+)= c(OH-)>c(CO32-) ③pH=10
(1)根据题意反应后,溶液中的溶质是HA和NaA,且二者的浓度都是0.05mol/L。溶液显碱性,说明水解程度大于电离程度,所以选项ABC都是错误的。根据物料守恒和电荷守恒定律可知,2c(Na+)=c(HA)+c(A-)、c(H+)+c(Na+)=c(OH-)+c(A-),因此选项D正确,答案选D。
(2)①碳酸钠和盐酸反应的过程是Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑。所以根据图像可知,H2CO3和CO32-不能大量共存。溶液中各种离子其物质的量浓度的大小关系是
②根据图像可知,pH=7时,消耗盐酸的体积大于20ml,所以c(Na+)>c(Cl-)>c(HCO3-)>c(H+)= c(OH-)>c(CO32-)。
③根据平衡常数表达式可知当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液中OH-浓度是1×10-4mol/L,所以pH=10。
(2)①碳酸钠和盐酸反应的过程是Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑。所以根据图像可知,H2CO3和CO32-不能大量共存。溶液中各种离子其物质的量浓度的大小关系是
②根据图像可知,pH=7时,消耗盐酸的体积大于20ml,所以c(Na+)>c(Cl-)>c(HCO3-)>c(H+)= c(OH-)>c(CO32-)。
③根据平衡常数表达式可知当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液中OH-浓度是1×10-4mol/L,所以pH=10。

练习册系列答案
相关题目
 CO2(aq) .△H=-19.75kJ·mol-1,为增大二氧化碳气体在水中的溶解度,应采用的方法是
CO2(aq) .△H=-19.75kJ·mol-1,为增大二氧化碳气体在水中的溶解度,应采用的方法是 H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表: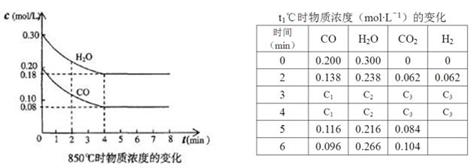
 CO2(g)+H2(g),该反应是放热反应
CO2(g)+H2(g),该反应是放热反应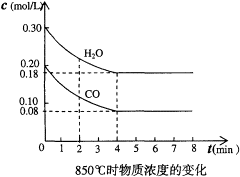
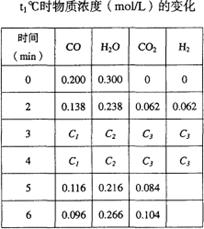
 N2 + 3H2,在某温度下的平衡常数为0.25,那么,在此条件下,氨的合成反应1/2 N2 + 3/2 H2
N2 + 3H2,在某温度下的平衡常数为0.25,那么,在此条件下,氨的合成反应1/2 N2 + 3/2 H2 2AB3(g)达到平衡的标志是
2AB3(g)达到平衡的标志是 I2 + I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大
I2 + I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大 CO2(g)+H2(g),反应物CO的物质的量在不同温度时物质的量随时间的变化如下表所示,回答下列问题:
CO2(g)+H2(g),反应物CO的物质的量在不同温度时物质的量随时间的变化如下表所示,回答下列问题: