题目内容
2.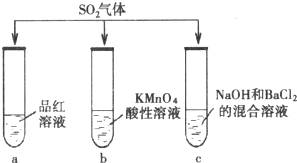 探究SO2的性质.甲组同学将SO2分别通入下列3种溶液中.
探究SO2的性质.甲组同学将SO2分别通入下列3种溶液中.(1)试管a中观察到的现象是溶液褪色.
(2)试管b中观察到紫色褪去,说明SO2具有的性质是还原性.
(3)试管c中产生了能溶于稀盐酸的白色沉淀,该白色沉淀是BaSO3.
(4)乙组同学多做了一组实验,他们将SO2通入盛有1.0mol/L Fe(NO3)3和BaCl2的混合溶液(已知1.0mol/L Fe(NO3)3溶液中c(H+)=0.1mol/L)的试管d中,得到了不溶于稀盐酸的白色沉淀.分析产生该白色沉淀的原因:
观点1:SO2与Fe3+反应
观点2:在酸性条件下SO2与NO3-反应
观点3:SO2和Fe3+、酸性条件下NO3-都反应.
欲证明观点2,只需将试管d中Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验.应选择的试剂是c(填字母).
a.0.1mol/L稀硝酸
b.1.5mol/L Ba(NO3)2和0.1mol/L HNO3的混合溶液
c.6.0mol/L NaNO3和0.2mol/L盐酸等体积混合的溶液.
分析 (1)二氧化硫具有漂白性;
(2)二氧化硫具有还原性,能被高锰酸钾氧化;
(3)二氧化硫为酸性氧化物,与NaOH反应生成亚硫酸钠,再与氯化钡反应;
(4)三价铁离子、硝酸根离子在酸性环境下都具有强的氧化性,都能够氧化二氧化硫.
解答 解:(1)二氧化硫具有漂白性,能够使品红溶液褪色,故答案为:溶液褪色;
(2)二氧化硫具有还原性能够还原酸性的高锰酸钾,使高锰酸钾褪色,故答案为:还原性;
(3)二氧化硫为酸性氧化物,能够与氢氧化钠反应生成亚硫酸钠,亚硫酸钠与氯化钡反应生成亚硫酸钡沉淀,亚硫酸钡与盐酸反应生成氯化钡和二氧化硫和水;
故答案为:BaSO3;
(4)Fe3+、酸性条件下NO3-都能氧化SO2,即SO2和Fe3+、酸性条件下的NO3-都反应,所以可能情况有三种:
观点1:SO2与Fe3+反应,
观点2:在酸性条件下SO2与NO3-反应,
观点3:SO2和Fe3+、酸性条件下NO3-都反应;
要证明观点2:在酸性条件下SO2与NO3-反应,则需要排除三价铁离子的干扰,选择酸性环境下的硝酸根离子,只有c合理,
故答案为:SO2和Fe3+、酸性条件下NO3-都反应;c.
点评 本题考查二氧化硫的性质实验探究,把握二氧化硫的性质是解题关键,注意实验设计的科学性,题目难度不大.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
1.下列说法不正确的是( )
| A. | 因SiO2不溶于水,故SiO2不是酸性氧化物 | |
| B. | 在反应SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑中SiO2作氧化剂 | |
| C. | SiO2是一种空间立体网状结构的晶体,熔点高、硬度大 | |
| D. | 氢氟酸能够刻蚀玻璃,故不能用玻璃瓶来盛装氢氟酸 |
13.工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2,在该反应中( )
| A. | 硫元素既被氧化又被还原 | |
| B. | 氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 每生成1 mol Na2S2O3,转移4 mol电子 | |
| D. | 相同条件下,每吸收10 m3SO2就会放出2.5 m3CO2 |
10.下列选项的离子方程式所对应的化学反应正确的是( )
| 选项 | 离子方程式 | 所对应的化学反应 |
| A | HCO3-+OH-+Ca2+═CaCO3↓+H2O | 既可以表示少量NaHCO3与过量石灰水反应,也可以表示少量NaOH与过量Ca(HCO3)2反应 |
| B | H++OH-═H2O | 代表任何强酸与强碱反应 |
| C | Fe+2H+═Fe2++H2↑ | 代表铁与所有强酸反应 |
| D | Al3++4NH3•H2O═4NH4++AlO2-+2H2O | 代表可溶性铝盐与过量氨水反应 |
| A. | A | B. | B | C. | C | D. | D |
17.一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数Ksp=cm(An+)•cn(Bm-),称为难溶电解质的溶度积.已知下表数据:
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不科学的是( )
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
| A. | 向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀 | |
| B. | 该溶液中c(SO42-):[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5:4 | |
| C. | 向该溶液中加入适量氯水,并调节pH到3~4后过滤,可获得纯净的CuSO4溶液 | |
| D. | 在pH=5的溶液中Fe3+不能大量存在 |
7.下列几种微粒中能影响水的电离平衡,且能使水的电离平衡逆向移动的是( )
| A. | HSO4- | B. | Cl- | C. | 13X3+ | D. | 16X2- |
14.下列冶炼金属的反应原理,错误的是( )
| A. | 2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑ | B. | MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑ | ||
| C. | 3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe | D. | Cu+2FeCl3═CuCl2+2FeCl2 |
11.某溶液中由水电离产生的c(H+)=1×10-10mol•L-1,该溶液的溶质不可能是( )
| A. | Ca(OH)2 | B. | HCl | C. | NaHCO3 | D. | CH3COOH |