题目内容
11.某溶液中由水电离产生的c(H+)=1×10-10mol•L-1,该溶液的溶质不可能是( )| A. | Ca(OH)2 | B. | HCl | C. | NaHCO3 | D. | CH3COOH |
分析 常温下,水的离子积为1×10-14,由水电离产生的c(H+)等于10-10mol/L,说明该溶液中的溶质抑制了水的电离,该溶液为酸性或者碱性溶液,据此进行判断.
解答 解:由水电离产生的c(H+)等于10-10mol/L,说明溶液中的溶质抑制了水的电离,而根据水的电离方程式可知,酸或碱能抑制水的电离,而盐的水解能促进水的电离.
Ca(OH)2、HCl、CH3COOH都能电离出氢氧根离子或氢离子,抑制水的电离;而NaHCO3电离出的碳酸氢根离子结合水电离的氢离子,促进了水的电离,水的电离程度增大,故选C.
点评 本题考查水的电离及其影响因素,难度不大.注意酸碱溶液抑制水的电离,含有弱酸根或弱碱根离子的盐溶液促进水的电离.

练习册系列答案
相关题目
19.在25℃和1×105Pa 时,将气态物质中的1mol A-B键拆成气态A原子和B原子,所需要的能量称为键能(单位:kJ/mol).下面是一些共价键的键能:
(1)根据上表中的数据判断工业合成氨的反应是放热(填“吸热”或“放热”)反应.
(2)在298K时,取1mol N2和3mol H2放入一密闭容器中,在催化剂存在下进行反应.理论上放出或吸收的热量为Q1,则Q1为93kJ.
(3)实际生产中,放出或吸收的热量为Q2,Q1与Q2的大小关系是Q1>Q2,理由该反应为可逆反应,在密闭容器中进行反应达到平衡时,1 mol N2和3 mol H2不能完全反应生成2 mol NH3,因而放出热量小于93 kJ.
| 化学键 | H-H | N≡N | N-H |
| 键能(kJ/mol) | 436 | 946 | 391 |
(2)在298K时,取1mol N2和3mol H2放入一密闭容器中,在催化剂存在下进行反应.理论上放出或吸收的热量为Q1,则Q1为93kJ.
(3)实际生产中,放出或吸收的热量为Q2,Q1与Q2的大小关系是Q1>Q2,理由该反应为可逆反应,在密闭容器中进行反应达到平衡时,1 mol N2和3 mol H2不能完全反应生成2 mol NH3,因而放出热量小于93 kJ.
6.一种化学冰袋中含有Na2SO4•10H2O和NH4NO3,将它们混合并用手搓揉就可制冷,且制冷效果能维持一段时间.以下关于其制冷原因的推测,肯定错误的是( )
| A. | Na2SO4•10H2O脱水是吸热过程 | |
| B. | 较长时间制冷是由于Na2SO4•10H2O脱水是较慢的过程 | |
| C. | 铵盐在该条件下,发生的复分解反应是吸热反应 | |
| D. | NH4NO3溶于水会吸收热量 |
16.t℃时,水的离子积为Kw,该温度下,将一元酸HA与一元碱BOH的溶液混合,下列关系式中,可确认溶液一定呈中性的是( )
| A. | pH=7 | B. | c(A-)>c(B+) | ||
| C. | c(OH-)=$\sqrt{{K}_{w}}$ | D. | c(H+)-c(OH-)=c(A-)-c(B+) |
3. 某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g)△H<0,如图表示该反应的速率随时间变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )
某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g)△H<0,如图表示该反应的速率随时间变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )
 某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g)△H<0,如图表示该反应的速率随时间变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )
某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g)△H<0,如图表示该反应的速率随时间变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )| A. | t2时升高了温度 | |
| B. | t3时降低了温度 | |
| C. | t5时增大了压强(缩小容器体积) | |
| D. | 平衡状态时,t6时刻Z的百分含量最低 |
20.如图是一些常见有机物的转化关系,下列说法正确的是( )
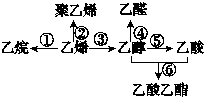

| A. | 反应①、③均属于取代反应 | B. | 反应②、④均属于氧化反应 | ||
| C. | 加入酸性K2Cr2O7溶液可实现反应⑤ | D. | 加入NaOH溶液可实现反应⑥ |
1.已知4NH3+5O2═4NO+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是( )
| A. | $\frac{4}{5}$ v(NH3)=v(O2) | B. | $\frac{5}{6}$ v(O2)=v(H2O) | C. | $\frac{2}{3}$ v(NH3)=v(H2O) | D. | $\frac{4}{5}$ v(O2)=v(NO) |
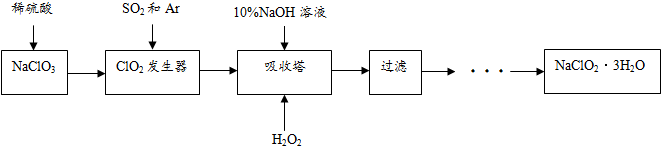
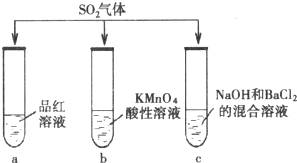 探究SO2的性质.甲组同学将SO2分别通入下列3种溶液中.
探究SO2的性质.甲组同学将SO2分别通入下列3种溶液中.