题目内容
下列解释实验事实的方程式不正确的是
A.葡萄糖的酯化反应若用浓硫酸作催化剂会炭化发黑:C6H12O6(葡萄糖)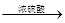 6C+6H2O 6C+6H2O |
| B.向AgNO3溶液中加入过量Na2S溶液后,再加NaCl稀溶液,黑色沉淀变成白色:Ag2S + 2Cl- =" 2AgCl↓+" S2- |
C.将NH3通入滴有酚酞的水中,溶液变红:NH3+ H2O  NH3·H2O NH3·H2O  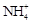 + OH- + OH- |
D.明矾的水溶液pH<7:Al3++ 3H2O  Al(OH)3(胶体)+3H+ Al(OH)3(胶体)+3H+ |
B
解析试题分析:由于硫化银溶解度小于氯化银,故无法发生B选项所述的变化,故错误。
考点:难溶电解质的溶解平衡及沉淀转化的本质 ,浓硫酸的性质,盐类水解。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
如图所示,大试管里充满某混合气体,置于光亮处,将滴管里的水挤入大试管后,烧杯中的水会进入大试管,大试管里的气体可能是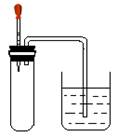
①N2、H2;②CO、O2; ③NO2、O2;④CH4、Cl2
| A.①或③ | B.②或④ | C.①或③或④ | D.③或④ |
用右图所示装置进行实验,下列对实验现象的解释不合理的是
| | ①中试剂 | ①中现象 | 解 释 |
| A | Ba(NO3)2溶液 | 生成白色沉淀 | SO32-与Ba2+生成白色BaSO3沉淀 |
| B | 品红溶液 | 溶液褪色 | SO2具有漂白性 |
| C | 紫色石蕊溶液 | 溶液变红 | SO2与水反应生成酸 |
| D | 酸性KMnO4溶液 | 紫色褪去 | SO2具有还原性 |
向FeCl3和BaCl2的混合液中通入过量SO2,有白色沉淀产生。下列说法正确的是
| A.白色沉淀为BaSO3 | B.该实验表明FeCl3有还原性 |
| C.反应后溶液酸性增强 | D.反应后滴加KSCN溶液显红色 |
下列中的实验一定不会出现沉淀现象的是( )
| A.CO2气体通入Na2SiO3溶液中 |
| B.SO2气体通入BaCl2溶液中 |
| C.CO2气体通入饱和Na2CO3溶液中 |
| D.SO2气体通入Ba(OH)2溶液中 |
硅及其化合物在材料领域中应用广泛。下列叙述中,正确的是( )。
| A.晶体硅是良好的半导体材料 |
| B.硅是地壳中含量最多的元素 |
| C.SiO2不溶于水,也不溶于任何酸 |
| D.用带玻璃瓶塞的试剂瓶盛放NaOH溶液 |
右图是一种试验某气体化学性质的实验装置。在A处通入氯气,图中B为开关,关闭B时,C中红色布条颜色无变化;打开B时,C处红色布条颜色褪去。由此做出的判断正确的是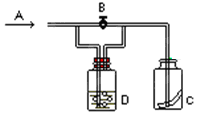
| A.D中可以是水 | B.D中可以是饱和食盐水 |
| C.D中不可能是浓H2SO4 | D.通入的氯气中含有水蒸气 |
下列物质既能通过与Cl2化合反应制取,也能通过与盐酸反应制取的是
| A.CuCl2 | B.FeCl2 | C.FeCl3 | D.ZnCl2 |