题目内容
向FeCl3和BaCl2的混合液中通入过量SO2,有白色沉淀产生。下列说法正确的是
| A.白色沉淀为BaSO3 | B.该实验表明FeCl3有还原性 |
| C.反应后溶液酸性增强 | D.反应后滴加KSCN溶液显红色 |
C
解析试题分析:A、二氧化硫被氧化为硫酸,生成的沉淀为硫酸钡,故A错误;B、反应中溶液由由棕黄色变成浅绿色,三价铁变化为二价铁,该实验表明FeCl3具有氧化性,故B错误;C、反应后生成硫酸酸性增强,故C正确;D、过量二氧化硫通入溶液中被三氯化铁氧化为硫酸,三氯化铁被还原为二价铁盐,反应后向溶液中滴加KSCN溶液,不显血红色,故D错误;故选C。
考点:本题考查了二氧化硫、三氯化铁、硫酸的化学性质及反应现象.熟练掌握基础是解题关键,题目中等。

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案
相关题目
将铁粉和硫粉混合无明显现象,加热,待反应一发生就立刻停止加热,反应可以持续进行,直至完全生成新物质硫化亚铁。该现象说明了
| A.该反应是分解反应 |
| B.该反应是放热反应 |
| C.该反应生成物的化学式为 Fe2S3 |
| D.生成物硫化亚铁的总能量高于反应物铁粉和硫粉的总能量 |
某同学用滤纸折成一个纸蝴蝶并喷洒一种溶液(保持湿润),挂在铁架台上。另取一只盛某种溶液的烧杯,放在纸蝴蝶的下方(如图)。过一会,发现纸蝴蝶变为蓝色。下表的组合中,能够实现上述变化的是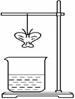
| | A | B | C | D |
| 纸蝴蝶上的喷洒液 | 酚酞 | KI-淀粉溶液 | 石蕊 | 品红 |
| 小烧杯中的溶液 | 浓氨水 | 浓氯水 | 浓盐酸 | 浓硫酸 |
浓硫酸有许多重要的性质,在与含有水分的蔗糖作用过程中不能显示的性质是
| A.酸性 | B.脱水性 | C.强氧化性 | D.吸水性 |
我们看到的普通玻璃一般呈淡绿色,这是因为在制造玻璃的过程中加入了( )
| A.氧化钴 | B.二价铁 |
| C.氧化亚铜 | D.氧化镁 |
下列解释实验事实的方程式不正确的是
A.葡萄糖的酯化反应若用浓硫酸作催化剂会炭化发黑:C6H12O6(葡萄糖)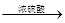 6C+6H2O 6C+6H2O |
| B.向AgNO3溶液中加入过量Na2S溶液后,再加NaCl稀溶液,黑色沉淀变成白色:Ag2S + 2Cl- =" 2AgCl↓+" S2- |
C.将NH3通入滴有酚酞的水中,溶液变红:NH3+ H2O  NH3·H2O NH3·H2O  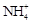 + OH- + OH- |
D.明矾的水溶液pH<7:Al3++ 3H2O  Al(OH)3(胶体)+3H+ Al(OH)3(胶体)+3H+ |
下列说法正确的是
| A.水泥、玻璃、陶瓷、水晶都属于硅酸盐产品 |
| B.二氧化碳通入水玻璃可以得到硅酸 |
| C.因为高温时二氧化硅与碳酸钠反应放出二氧化碳,所以酸性硅酸比碳酸强 |
| D.可以用澄清石灰水鉴别SO2和CO2 |
如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了。则液体A和气体B的组合不可能是下列的:
| A.氢氧化钠溶液、二氧化碳 | B.硝酸银溶液、氯化氢 |
| C.水、氨气 | D.水、一氧化碳 |
不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是( )
| 序号 | 甲 | 乙 | 丙 |
| ① | CO2 | SO2 | 石灰水 |
| ② | HCl | CO2 | 石灰水 |
| ③ | CO2 | SO2 | Ba(NO3)2 |
| ④ | NO2 | SO2 | BaCl2 |
| ⑤ | CO2 | NH3 | CaCl2 |
A.①②③④ B.②③④⑤ C.①③④ D.②③④