题目内容
二氧化氯(ClO2)是目前国际上公认的第四代高效、无毒的消毒剂,是一种黄绿色的气体,易溶于水。
Ⅰ.(1)ClO2可由KClO3在H2SO4存在的条件下与Na2SO3反应制得。则该反应的氧化产物与还原产物的物质的量之比是________。
Ⅱ.实验室也可用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2,其流程如下:
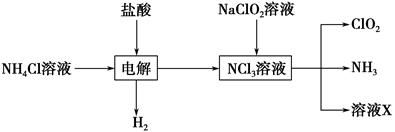
(2)写出电解时发生反应的化学方程式:________________________________。
(3)除去ClO2中的NH3可选用的试剂是________。(填序号)
(4)测定ClO2(如图)的过程如下:在锥形瓶中加入足量的碘化钾,用100 mL水溶解后,再加3 mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用c mol·L-1硫代硫酸钠标准溶液滴定(I2+2S2O32-=2I-+S4O62-),共用去V mL硫代硫酸钠溶液。

①装置中玻璃液封管的作用是______________________________________。
②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式__________________________。
③滴定终点的现象是_______________________________________________。
④测得通入ClO2的质量m(ClO2)=________。(用含c、V的代数式表示)
(5)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子ClO2-。2001年我国卫生部规定,饮用水的ClO2-含量应不超过0.2 mg·L-1。若饮用水中ClO2-的含量超标,可向其中加入适量的某还原剂,该反应的氧化产物是________(填化学式),其发生反应的离子方程式为_________________________________________________________________。
Ⅰ.(1)ClO2可由KClO3在H2SO4存在的条件下与Na2SO3反应制得。则该反应的氧化产物与还原产物的物质的量之比是________。
Ⅱ.实验室也可用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2,其流程如下:

(2)写出电解时发生反应的化学方程式:________________________________。
(3)除去ClO2中的NH3可选用的试剂是________。(填序号)
| A.饱和食盐水 | B.碱石灰 |
| C.浓硫酸 | D.水 |

①装置中玻璃液封管的作用是______________________________________。
②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式__________________________。
③滴定终点的现象是_______________________________________________。
④测得通入ClO2的质量m(ClO2)=________。(用含c、V的代数式表示)
(5)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子ClO2-。2001年我国卫生部规定,饮用水的ClO2-含量应不超过0.2 mg·L-1。若饮用水中ClO2-的含量超标,可向其中加入适量的某还原剂,该反应的氧化产物是________(填化学式),其发生反应的离子方程式为_________________________________________________________________。
(1)1∶2
(2)NH4Cl+2HCl 3H2↑+NCl3 (3)C
3H2↑+NCl3 (3)C
(4)①吸收残余的二氧化氯气体,并使锥形瓶内外压强相等 ②2ClO2+10I-+8H+=4H2O+5I2+2Cl- ③滴下最后一滴Na2S2O3溶液时,溶液由蓝色变为无色,且半分钟内不复原 ④1.35cV×10-2 g
(5)Fe(OH)3 ClO2-+4Fe2++2H2O+8OH-=4Fe(OH)3↓+Cl-
(2)NH4Cl+2HCl
 3H2↑+NCl3 (3)C
3H2↑+NCl3 (3)C(4)①吸收残余的二氧化氯气体,并使锥形瓶内外压强相等 ②2ClO2+10I-+8H+=4H2O+5I2+2Cl- ③滴下最后一滴Na2S2O3溶液时,溶液由蓝色变为无色,且半分钟内不复原 ④1.35cV×10-2 g
(5)Fe(OH)3 ClO2-+4Fe2++2H2O+8OH-=4Fe(OH)3↓+Cl-
(1)设氧化产物Na2SO4、还原产物ClO2的物质的量分别为x、y,则2x=y,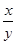 =
=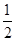 。
。
(2)根据电解时有H2、NCl3生成,所以电解时反应的化学方程式为NH4Cl+2HCl 3H2↑+NCl3。
3H2↑+NCl3。
(3)因为ClO2能和水、碱反应,所以应用浓硫酸除去NH3。(4)玻璃液封管中的水可以吸收残余的ClO2气体,并使锥形瓶内外压强相等。ClO2可把I-氧化成I2,离子方程式为2ClO2+10I-+8H+=4H2O+5I2+2Cl-,I2+2S2O32-=2I-+S4O62-
ClO2 ~ 5S2O32-
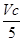 ×10-3 mol V×10-3L×c mol·L-1
×10-3 mol V×10-3L×c mol·L-1
=Vc×10-3mol
所以m(ClO2)=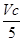 ×10-3mol×67.5 g·mol-1=1.35Vc×10-2g。
×10-3mol×67.5 g·mol-1=1.35Vc×10-2g。
(5)处理ClO2-可用Fe2+还原,其氧化产物为Fe(OH)3,离子方程式为ClO2-+4Fe2++2H2O+8OH-=4Fe(OH)3↓+Cl-。
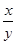 =
=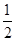 。
。(2)根据电解时有H2、NCl3生成,所以电解时反应的化学方程式为NH4Cl+2HCl
 3H2↑+NCl3。
3H2↑+NCl3。(3)因为ClO2能和水、碱反应,所以应用浓硫酸除去NH3。(4)玻璃液封管中的水可以吸收残余的ClO2气体,并使锥形瓶内外压强相等。ClO2可把I-氧化成I2,离子方程式为2ClO2+10I-+8H+=4H2O+5I2+2Cl-,I2+2S2O32-=2I-+S4O62-
ClO2 ~ 5S2O32-
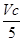 ×10-3 mol V×10-3L×c mol·L-1
×10-3 mol V×10-3L×c mol·L-1=Vc×10-3mol
所以m(ClO2)=
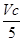 ×10-3mol×67.5 g·mol-1=1.35Vc×10-2g。
×10-3mol×67.5 g·mol-1=1.35Vc×10-2g。(5)处理ClO2-可用Fe2+还原,其氧化产物为Fe(OH)3,离子方程式为ClO2-+4Fe2++2H2O+8OH-=4Fe(OH)3↓+Cl-。

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目

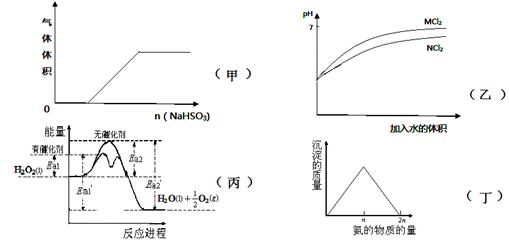
 Cu2++2NO2↑+2H2O
Cu2++2NO2↑+2H2O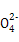 +Ba2++3OH-
+Ba2++3OH- Fe(OH)3↓+BaSO4↓
Fe(OH)3↓+BaSO4↓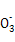 +HClO
+HClO
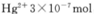 ,是否达到了排放标准_______(填“是”或“否”)。
,是否达到了排放标准_______(填“是”或“否”)。
 NH3↑+H2O
NH3↑+H2O CH3COOH+OH-
CH3COOH+OH-