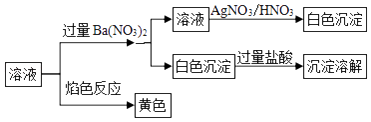
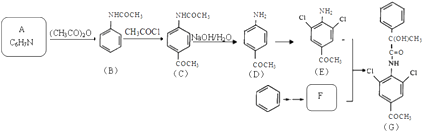
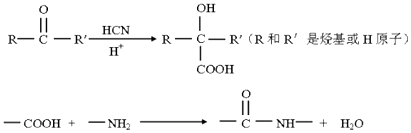
��Ŀ����
����Ŀ��Q��R��X��Y��ZΪ���ڱ�ǰ������Ԫ�أ�ԭ���������ε�������֪��
��QΪԪ�����ڱ���ԭ�Ӱ뾶��С��Ԫ�أ�
��R�Ļ�̬ԭ���е���ռ������������ͬ��ԭ�ӹ������ÿ�ֹ���еĵ���������ͬ��
��Y�Ļ�̬ԭ�ӵĺ���ɶԵ�������δ�ɶԵ�������3����
��Q��R��Y����Ԫ����ɵ�һ�ֻ�����M����װ�����г����е�һ���к����壬Q��R����Ԫ����ɵ�ԭ�Ӹ�����Ϊ1��1�Ļ�����N����ѧ��ѧ�г������л��ܼ���
��Z�С����������֮�ƣ�Z4+���Ӻ��ԭ�ӵĺ�������Ų���ͬ��
��ش��������⣨����ʱ��Q��R��X��Y��Z������Ӧ��Ԫ�ط��ű�ʾ��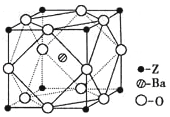
��1��������M�Ŀռ乹��Ϊ ��������ԭ�Ӳ�ȡ�� �ӻ���������N�ڹ�̬ʱ�ľ�������Ϊ
��2��R��X��Y����Ԫ�صĵ�һ��������С�����˳��Ϊ
��3��������һ�ֻ����Ԫ����ɵ���RY2��Ϊ�ȵ�����ķ���Ϊ ��д����ʽ��
��4����R��X��Y����Ԫ����ɵ�RXY�����������������¿���NaClO��Һ��Ӧ������X2��RY2�����ʣ��÷�Ӧ�����ӷ���ʽΪ
��5��Zԭ�ӻ�̬ʱ����Χ�����Ų�ʽΪ�� ��Z��һ�ֺ����ᱵ�εľ����ṹ��ͼ��ʾ����������ÿ��Zԭ�ӵȾ������������ԭ����Ϊ
���𰸡�
��1��ƽ�������Σ�sp2�����Ӿ���
��2��C��O��N
��3��N2O
��4��2CNO��+2H++3ClO���TN2��+2CO2��+3C1��+H2O
��5��3d24s2��6
������������Ϣ��֪��QΪ��Ԫ�أ�RΪ̼Ԫ�أ�XΪNԪ�أ�YΪ��Ԫ�أ�ZΪ��Ԫ�أ�MΪ��ȩ��NΪ����
��1��������MΪ��ȩ��̼ԭ�ӵŵ��Ӷ���Ϊ0��̼ԭ�ӵĦҼ���Ϊ3����̼ԭ�Ӳ�ȡsp2�ӻ����ռ�ṹΪƽ�������Σ�������NΪ��������̼����Ԫ����ɵĻ���������ɱ�����ֱ�ӹ��ɵģ���N�ڹ�̬ʱ�ľ�������Ϊ���Ӿ��壬���Դ��ǣ�ƽ�������Σ�sp2�����Ӿ��壻
��2��R��X��Y����Ԫ�صķֱ�ΪC��N��O���ǽ�����Խǿ��Ԫ�صĵ�һ������Խ��Nԭ�ӵĵ����Ų���P�����������ʧȥ1�����Ӹ��ѣ�������Ԫ����NԪ�صĵ�һ���������
���Դ��ǣ�C��O��N��
��3��RY2ΪCO2 �� ��������3��ԭ�ӣ��۵�����Ϊ4+6��2=16��N2O�ķ�������3��ԭ�ӣ��۵�����Ϊ5��2+6=16����CO2��N2O��Ϊ�ȵ����壬���Դ��ǣ�N2O��
��4����RXY�����������������¿���NaClO��Һ��Ӧ������X2��RY2�����ʣ��ɷ�Ӧ�������������Ԫ���غ㡢����غ㣬�����ӷ���ʽΪ2CNO��+2H++3ClO���TN2��+2CO2��+3C1��+H2O��
���Դ��ǣ�2CNO��+2H++3ClO���TN2��+2CO2��+3C1��+H2O��
��5����Z4+���Ӻ��ԭ�ӵĺ�������Ų���ͬ����Z��ԭ������Ϊ22����ZΪ��Ԫ�أ�����ӻ�̬�����Ų�Ϊ1S22S22P63S23P63d24s2 �� ����������3d���ӣ�����Χ�����Ų�Ϊ
3d24s2 �� �ɾ���ṹͼ��֪����������ÿ��Zԭ�ӵȾ������������ԭ�������λ�ã�����ԭ����Ϊ![]() =6�����Դ��ǣ�3d24s2��6��
=6�����Դ��ǣ�3d24s2��6��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ���±��г��ˢ�����ʮ��Ԫ�������ڱ��е�λ�ã�
��A | ||||||||
1 | �� | ��A | ��A | ��A | ��A | ��A | ��A | |
2 | �� | �� | �� | |||||
3 | �� | �� | �� | �� | �� | �� |
�밴Ҫ��ش��������⡣
��1��Ԫ�آ��Ӧ�ļ����ӵĽṹʾ��ͼ��____________��
��2������Ԫ���У���ѧ��������õ��� ____________����Ԫ�ط��ţ���
��3��д��Ԫ�آ��γɵĵ����ڿ�����ȼ�յĻ�ѧ����ʽ______________________����һ��Ӧ��____________(��������������������)��Ӧ��
��4���õ���ʽ��ʾ������γɵ�A2B�ͻ�������γɹ���___________________________��
��5������ЩԪ�ص�����������Ӧˮ�����У�������ǿ�Ļ�����ķ���ʽ�ǣ�__________����Ԫ�آ�����������Ӧˮ����������Ӧʱ�����ӷ���ʽΪ________________
��6���۵ļ��⻯����۵�����������Ӧ��ˮ���ﷴӦ���������к��еĵĻ�ѧ����____________________________��