题目内容
【题目】将不可再生的天然气、石油、煤等化石燃料转化利用、变废为宝已成为当务之急。
(1)根据键能数据估算CH4+4F2=CF4+4HF的反应热ΔH= 。
化学键 | C—H | C—F | H—F | F—F |
键能/(kJ·mol-1) | 414 | 489 | 565 | 155 |
(2)甲醇、二甲醚(CH3OCH3)被称为21世纪的新型燃料,均可利用CO和H2反应合成。
①某燃料电池以二甲醚为原料,熔融碳酸盐为电解质,其负极反应如下:
CH3OCH3+6CO![]() -12e-=8CO2+3H2O。写出该燃料电池的正极反应式: 。
-12e-=8CO2+3H2O。写出该燃料电池的正极反应式: 。
②废水中含甲醇对水质会造成污染,Co3+可将甲醇氧化为CO2。某同学以Pt作电极电解酸性含甲醇废水与CoSO4混合液模拟工业除污原理,其阳极反应式为 。
(3)某企业采用如图所示原理处理化石燃料开采、加工过程产生的H2S废气。
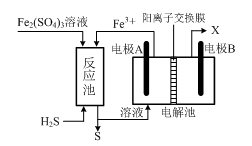
①电解池中电极A、B均为惰性电极,其中A为电解池的 极;电极B所得到的物质X的分子式为 。
②反应池中发生的离子反应方程式为 。
【答案】(1)–1940 kJ·mol-1
(2)①2CO2+O2+4e-=2CO![]() (或将各计量数扩大3倍)②Co2+-e-=Co3+
(或将各计量数扩大3倍)②Co2+-e-=Co3+
(3)①阳 H2②H2S+2Fe3+=2Fe2++S↓+2H+
【解析】
试题分析:(1)根据键能数据,焓变等于反应物的总键能-生成物的总键能,CH4+4F2=CF4+4HF的反应热ΔH=414×4+155×2-489×4-565×4=–1940 kJ·mol-1;(2)①原电池正极发生还原反应,某燃料电池以二甲醚为原料,熔融碳酸盐为电解质正反应为![]() ,其负极反应CH3OCH3+6CO
,其负极反应CH3OCH3+6CO![]() -12e-=8CO2+3H2O。该燃料电池的正极反应式=总反应-负极反应,正极反应式CO2+O2+4e-=2CO
-12e-=8CO2+3H2O。该燃料电池的正极反应式=总反应-负极反应,正极反应式CO2+O2+4e-=2CO![]() ;②阳极发生氧化反应,阳极反应式为Co2+-e-=Co3+;(3)根据图示,A极有Fe3+生成,A是阳极,B是阴极发生还原反应,
;②阳极发生氧化反应,阳极反应式为Co2+-e-=Co3+;(3)根据图示,A极有Fe3+生成,A是阳极,B是阴极发生还原反应,![]() ,B所得到的 物质X的分子式为H2;②根据图示反应池中发生的离子反应方程式为H2S+2Fe3+=2Fe2++S↓+2H+。
,B所得到的 物质X的分子式为H2;②根据图示反应池中发生的离子反应方程式为H2S+2Fe3+=2Fe2++S↓+2H+。

【题目】分实验室用氢氧化钠固体配制1.0 mol·L-1的NaOH溶液250mL,回答下列问题:
(1)实验仪器:托盘天平、药匙、烧杯、玻璃棒、(量筒)、 。
(2)实验步骤:①计算:②称量,③溶解,④移液,⑤洗涤,⑥ ⑦摇匀。称量所需氯化钠的质量为 g。
(3)下列操作使所配溶液的浓度偏大的有________;
A.托盘天平的托盘放上纸称量NaOH |
B.未洗涤溶解NaOH的烧杯 |
C.溶解后未冷却就立即转移到容量瓶中 |
D.定容时俯视刻度线 |
E.摇匀,静置后发现液面不到刻度线,再加水至刻度线
F.容量瓶未干燥即用来配制溶液
(4)右图是实验步骤④的示意图,图中的错误是