题目内容
6.下列有关物质性质或应用的说法正确的是( )| A. | 二氧化锰具有强氧化性,能将双氧水氧化为氧气 | |
| B. | Zn具有氧化性和导电性,可用作锌锰干电池的负极材料 | |
| C. | 炭具有强还原性,高温下能将二氧化硅还原为硅 | |
| D. | 二氧化硫具有漂白性,与氯水混合使用效果会更好 |
分析 A.在双氧水的分解中,二氧化锰作催化剂;
B.Zn为活泼金属,可作原电池的负极;
C.碳具有还原性,能含有部分氧化物;
D.二氧化硫具有还原性,能和氯气发生氧化还原反应生成硫酸和盐酸而失去漂白性.
解答 解:A.二氧化锰具有强氧化性,但在双氧水的分解中,二氧化锰作催化剂而不是氧化剂,故A错误;
B.Zn为活泼金属具有还原性,具有良好的导电性,易失去电子,可作原电池的负极,故B错误;
C.碳和二氧化硅反应生成硅和一氧化碳,该反应中碳失电子而作还原剂,故C正确;
D.二氧化硫具有还原性,氯气具有氧化性,在水溶液里,氯气和二氧化硫、水反应生成硫酸和盐酸而失去漂白性,故D错误;
故选C.
点评 本题考查了物质的性质及用途,明确物质的性质决定其用途是解本题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.下列关于各实验装置图的叙述中正确的是( )
| A. | 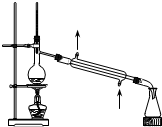 装置可用于分离苯和溴苯的混合物 | B. | 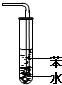 装置可用于吸收HCl或NH3气体 | ||
| C. |  用图所示装置分离乙醇与乙酸 | D. | 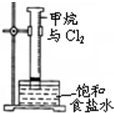 图中量筒中发生了加成反应 |
17.“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题.
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
 ①实验1中以v (CO2) 表示的反应速率为0.13mol/(L.min); (取小数二位,下同).
①实验1中以v (CO2) 表示的反应速率为0.13mol/(L.min); (取小数二位,下同).
②该反应为吸(填“吸”或“放”)热反应,实验2条件下平衡常数K=$\frac{1}{6}$.
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
③H2O(g)═H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8 kJ/mol.
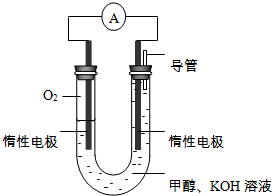
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.
①该电池正极的电极反应为O2+2H2O+4e-=4OH-.
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为2CH3OH+3O2+4KOH=2K2CO3+6H2O.
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mo1/L,则生成沉淀所需CaCl2溶液的最小浓度为5.6×10-5mol/L.
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
 ①实验1中以v (CO2) 表示的反应速率为0.13mol/(L.min); (取小数二位,下同).
①实验1中以v (CO2) 表示的反应速率为0.13mol/(L.min); (取小数二位,下同).②该反应为吸(填“吸”或“放”)热反应,实验2条件下平衡常数K=$\frac{1}{6}$.
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
③H2O(g)═H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8 kJ/mol.
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.
①该电池正极的电极反应为O2+2H2O+4e-=4OH-.
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为2CH3OH+3O2+4KOH=2K2CO3+6H2O.
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mo1/L,则生成沉淀所需CaCl2溶液的最小浓度为5.6×10-5mol/L.
1.生产液晶显示器过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12000~20000倍,在大气中的寿命可长达740年之久,以下判断正确的是( )
| A. | NF3气体密度比空气小 | B. | 过程N(g)+3F(g)→NF3(g)放出热量 | ||
| C. | NF3属于易燃、高能物质 | D. | NF3室温条件下不稳定 |
18.(1)恒温、容积为1L恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示[已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ/mol].

请回答下列问题:
①写出能表示硫的燃烧热的热化学方程式:S(s)+O2(g)═SO2(g)△H=-297 KJ•mol-1.
②△H2=-78.64 kJ/mol.
③在相同条件下,充入1mol SO3和0.5mol O2,则达到平衡时SO3的转化率为20%;此时该反应吸收(填“放出”或“吸收”)19.66 kJ的能量.
(2)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.①有效“减碳”的手段之一是节能,下列制氢方法最节能的是C(填序号).
A.电解水制氢:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑
B.高温使水分解制氢:2H2O(g)$\frac{\underline{\;高温\;}}{\;}$2H2+O2↑
C.太阳光催化分解水制氢:2H2O $\frac{\underline{\;\;\;TiO_{2}\;\;\;}}{太阳光}$2H2↑+O2↑
D.天然气制氢:CH4+H2O(g) $\stackrel{高温}{?}$CO+3H2
②CO2可转化成有机物实现碳循环.在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,测得CO2和CH3OH(g)浓度随时间变化如图2所示.
从3min到9min,υ(H2)=0.125 mol/(L•min).
③能说明上述反应达到平衡状态的是D(填编号).
A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.3个H-H键断裂的同时有4个C-H键断裂
D.CO2的体积分数在混合气体中保持不变
(3)工业上,CH3OH也可由CO和H2合成.参考合成反应CO(g)+2H2(g)?CH3OH(g)的平衡常数.
下列说法正确的是AB.
A.该可逆反应的正反应是放热反应
B.在T℃时,1L密闭容器中,投入0.1molCO和0.2molH2,达到平衡时,CO的转化率为50%,则此时的平衡常数为100
C.工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气的转化率最高.

请回答下列问题:
①写出能表示硫的燃烧热的热化学方程式:S(s)+O2(g)═SO2(g)△H=-297 KJ•mol-1.
②△H2=-78.64 kJ/mol.
③在相同条件下,充入1mol SO3和0.5mol O2,则达到平衡时SO3的转化率为20%;此时该反应吸收(填“放出”或“吸收”)19.66 kJ的能量.
(2)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.①有效“减碳”的手段之一是节能,下列制氢方法最节能的是C(填序号).
A.电解水制氢:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑
B.高温使水分解制氢:2H2O(g)$\frac{\underline{\;高温\;}}{\;}$2H2+O2↑
C.太阳光催化分解水制氢:2H2O $\frac{\underline{\;\;\;TiO_{2}\;\;\;}}{太阳光}$2H2↑+O2↑
D.天然气制氢:CH4+H2O(g) $\stackrel{高温}{?}$CO+3H2
②CO2可转化成有机物实现碳循环.在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,测得CO2和CH3OH(g)浓度随时间变化如图2所示.
从3min到9min,υ(H2)=0.125 mol/(L•min).
③能说明上述反应达到平衡状态的是D(填编号).
A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.3个H-H键断裂的同时有4个C-H键断裂
D.CO2的体积分数在混合气体中保持不变
(3)工业上,CH3OH也可由CO和H2合成.参考合成反应CO(g)+2H2(g)?CH3OH(g)的平衡常数.
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
A.该可逆反应的正反应是放热反应
B.在T℃时,1L密闭容器中,投入0.1molCO和0.2molH2,达到平衡时,CO的转化率为50%,则此时的平衡常数为100
C.工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气的转化率最高.
15.在一恒温恒容的密闭容器中,放入一定量的甲醇,发生反应:CH3OH(l)?CO(g)+2H2(g).以下可以作为该反应达到平衡状态的判断依据为( )
| A. | 容器内气体密度保持不变 | |
| B. | 气体的平均相对分子质量保持不变 | |
| C. | CO的体积分数保持不变 | |
| D. | CO与H2的物质的量之比保持1:2不变 |
16.下列有关物质分类的描述正确的是( )
| A. | 金属氧化物一定是碱性氧化物 | |
| B. | SO2水溶液能导电,所以 SO2是电解质 | |
| C. | 胶体是纯净物,可以用丁达尔效应鉴别胶体和溶液 | |
| D. | 人们在认识事物时往往需要采用多种分类方法,来弥补单一分类方法的不足 |
 ),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有6个.
),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有6个.
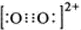 .已知CaC2晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为$\frac{256}{a{N}_{A}}$cm3.
.已知CaC2晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为$\frac{256}{a{N}_{A}}$cm3.