题目内容
下列叙述正确的是
A.pH=2的醋酸加水稀释100倍后,溶液pH值等于4。
B.室温下,物质的量浓度相同的苯甲酸钠溶液比碳酸钠溶液的碱性强。
C.相同温度下,pH=2的氯化铁溶液中水的电离度比pH=1的硫酸溶液中水的电离度大。
D.pH=3的溶液与pH=11的溶液等体积混合后,溶液一定呈中性
【答案】
C
【解析】
试题分析:醋酸加水稀释过程中,醋酸继续电离补充H+,所以pH=2的醋酸稀释100后溶液pH<4,A错误;酸性苯甲酸>H2CO3>HCO3-,所以室温下同浓度苯甲酸钠溶液的碱性小于碳酸钠,B错误;氯化铁水解,促进水的电离。硫酸抑制水的电离,C正确;pH=3的溶液与pH=11的溶液等体积混合后,溶液酸碱性无法确定,因不知两种溶液分别是何种溶液,D错误。
考点:溶液的稀释与pH 盐类的水解 水的电离 酸、碱混合后溶液的酸碱性
点评:室温下,pH=3的强酸与pH=11的强碱等体积混合后溶液呈中性;pH=3的弱酸与pH=11的强碱等体积混合后溶液呈酸性;pH=3的强酸与pH=11的弱碱等体积混合后溶液呈碱性。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
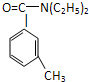 避蚊胺(又名DEET)是一种对人安全、活性高且无抗药性的新型驱蚊剂,其结构简式为:已知:RCOOH
避蚊胺(又名DEET)是一种对人安全、活性高且无抗药性的新型驱蚊剂,其结构简式为:已知:RCOOH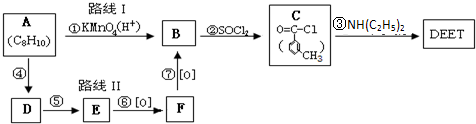
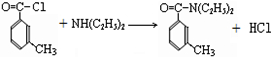
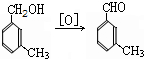
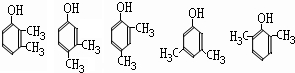 (任写2种)
(任写2种)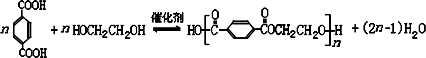
 NH3?H2O+H+
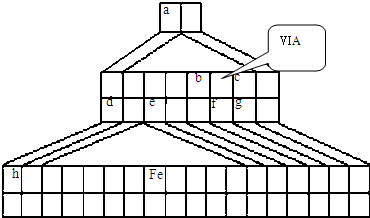
NH3?H2O+H+ (2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.
(2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.