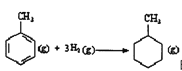题目内容
【题目】X、Y、Z、Q、W、R六种短周期元素原子序数依次增大。化合物甲由X、Z、Q三种元素组成,常温下0.1mol/L甲溶液的pH=13。工业上常用电解饱和QR溶液生成甲;化合物乙由X、R两种元素组成。请回答下列问题:

(1)Q的离子结构示意图为____________。
(2)Y元素的单质能发生如图所示的转化,请写出图中反应YZ2→YZ的化学方程式:___________(注明反应条件)。在甲溶液中通入足量YZ2气体,所得溶液呈碱性,写出该溶液中的阴离子浓度由大到小的顺序:______________。
(3)W的单质既能与甲溶液反应,又能与乙溶液反应。
① 常温下,将W的单质和甲溶液混合,发生反应的离子方程式为____________;
② Q、W金属性的强弱为Q>W,下列表述中正确的且能证明这一事实的是__________(填序号)
a. Q单质的熔点比W单质的低
b. W单质的硬度比Q大
c. Q单质能将W从它的盐溶液中置换出来
d. Q的最高价氧化物的水化物的碱性比W的最高价氧化物的水化物的碱性强
【答案】(1)![]() ;
;
(2)CO2+C![]() 2CO;c(HCO3-)>c(OH-)>c(CO32-);
2CO;c(HCO3-)>c(OH-)>c(CO32-);
(3)①2Al+2OH-+2H2O=2AlO2-+3H2↑ ②d
【解析】试题分析:X、Y、Z、Q、W、R六种短周期元素原子序数依次增大,化合物甲由X、Z、Q三种元素组成,常温下0.1mol/L甲溶液的pH=13,则甲为强碱,且为短周期元素,所以是氢氧化钠,X、Z、Q原子序数依次增大,所以X是H元素,Z是O元素,Q是Na元素,工业上常用电解饱和氯化钠溶液生成氢氧化钠,所以R是Cl元素;化合物乙由H、Cl两种元素组成,所以乙是HCl;W的单质既能与氢氧化钠溶液反应,又能与盐酸溶液反应,则W是Al元素,Y的原子序数小于O元素,Y和氧气能生成两种氧化物,根据其化合价知,Y为C元素。
(1)Q是Na元素,钠原子核外有11个电子、3个电子层,则钠的离子结构示意图为![]() ,故答案为:
,故答案为:![]() ;
;
(2)通过以上分析知,Y为C元素;二氧化碳与碳在高温下反应生成一氧化碳,反应的化学方程式为CO2+C![]() 2CO,甲为氢氧化钠,在氢氧化钠溶液中通入足量二氧化碳气体,所得碳酸氢钠溶液呈碱性,,是因为碳酸氢根离子水解程度大于电离程度,溶液中的阴离子浓度由大到小的顺序为c(HCO3-)>c(OH-)>c(CO32-),故答案为:CO2+C
2CO,甲为氢氧化钠,在氢氧化钠溶液中通入足量二氧化碳气体,所得碳酸氢钠溶液呈碱性,,是因为碳酸氢根离子水解程度大于电离程度,溶液中的阴离子浓度由大到小的顺序为c(HCO3-)>c(OH-)>c(CO32-),故答案为:CO2+C![]() 2CO;c(HCO3-)>c(OH-)>c(CO32-);
2CO;c(HCO3-)>c(OH-)>c(CO32-);
(3)①常温下,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,发生反应的离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
②Na、Al两种元素金属性的强弱为Q>W,金属的金属性越强,其对应最高价氧化物的水化物碱性越强,与酸反应越容易失去电子,故选d。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案