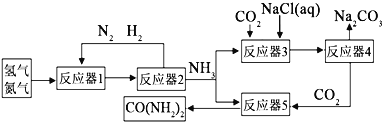
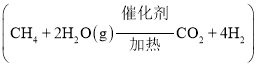题目内容
【题目】常温下,向某一元酸HR溶液中滴加一元碱BOH溶液,混合溶液的 或
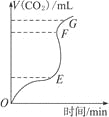
或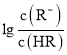 与pH变化的关系如图所示。下列叙述正确的是
与pH变化的关系如图所示。下列叙述正确的是![]()
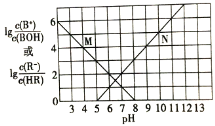
A.M线表示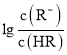 随pH的变化
随pH的变化
B.BR溶液呈碱性
C.若温度升高,两条线均向上平移
D.常温下,![]() 溶液的
溶液的![]()
【答案】C
【解析】
根据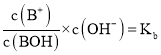 可知:
可知: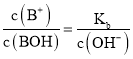 ,根据
,根据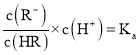 可知:
可知: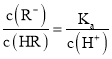 ,则随着pH增大,
,则随着pH增大,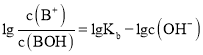 的值逐渐减小,
的值逐渐减小,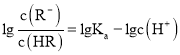 的值逐渐增大,所以M线表示
的值逐渐增大,所以M线表示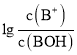 随pH的变化,N线表示
随pH的变化,N线表示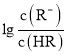 随pH的变化。
随pH的变化。
A.根据分析可知,M线表示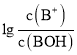 随pH的变化,故A错误;
随pH的变化,故A错误;
B.当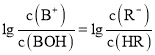 时,
时,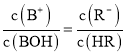 ,根据图象可知,
,根据图象可知,![]() ,溶液呈酸性,则
,溶液呈酸性,则![]() ,则
,则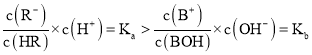 ,则BR溶液呈酸性,故B错误;
,则BR溶液呈酸性,故B错误;
C.升高温度,酸碱的电离平衡常数都变大,则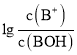 和
和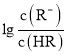 都增大,两条线均向上平移,故C正确;
都增大,两条线均向上平移,故C正确;
D.对于NaR溶液:![]()
起始:![]()
![]() 0 0
0 0
平衡:![]() x x
x x
由N线上的点可知![]() ,故常温下水解常数
,故常温下水解常数![]() ,则
,则![]() ,解得:
,解得:![]() ,
,![]() ,
,![]() ,故D错误;
,故D错误;

【题目】1,2-二溴乙烷可作抗爆剂的添加剂。如图为实验室制备1,2-二溴乙烷的装罝图,图中分液漏斗和烧瓶a中分别装有浓H2SO4和无水乙醇,d装罝试管中装有液溴。
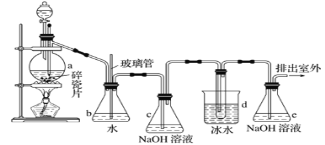
相关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | 溴 | |
状态 | 无色液体 | 无色液体 | 无色液体 | 红棕色液体 |
密度/g·cm-3 | 0.79 | 2.18 | 0.71 | 3.10 |
沸点/℃ | 78.5 | 131.4 | 34.6 | 58.8 |
熔点/℃ | -114.3 | 9.79 | - 116.2 | -7.2 |
水溶性 | 混溶 | 难溶 | 微溶 | 可溶 |
(1)装置a中发生主要反应的方程式为:___。为防止副反应发生,实验中的具体操作为:___。
(2)安全瓶b在实验中有多重作用。其一可以检查实验进行中d装罝中导管是否发生堵塞,如果实验时d装罝中导管堵塞,你认为可能的原因:___;安全瓶b还可以起到的作用是:___。
(3)容器c、e中都盛有NaOH溶液,c中NaOH溶液的作用是___。
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比理论值超过许多,如果装罝的气密性没有问题,试分析可能的原因:___、___(写出两条即可)。
【题目】硫酸铜是一种应用极其广泛的化工原料;以下是某工厂用含铁废铜为原料生产胆矾(CuSO45H2O)和副产物石膏(CaSO42H2O)的生产流程示意图:

胆矾和石膏在不同温度下的溶解度(g/100g水)见表。
温度(℃) | 20 | 40 | 60 | 80 | 100 |
石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
请回答下列问题:
(1)红棕色滤渣的主要成分是___;
(2)写出浸出过程中生成硫酸铜的离子方程式___;
(3)操作I包括蒸发浓缩、__等操作,温度应该控制在__℃左右;
(4)从溶液中分离出硫酸铜晶体的操作Ⅱ应为__、___、洗涤、干燥;晶体用无水乙醇作洗涤液而不用蒸馏水的原因是__;干燥时采用晾干,不用加热烘干的原因是___。
(5)取样检验是为了确认Fe3+是否除净。有同学设计了以下两种方案,在实验室分别对所取样品按下列方案进行操作:
方案一:取样于试管→滴加KSCN溶液; 方案二:纸层析→喷KSCN溶液;
①你认为上述两种方案设计更合理的是__;
②指出你认为不合理方案存在的问题是__。