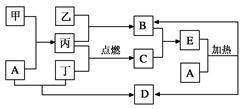
题目内容
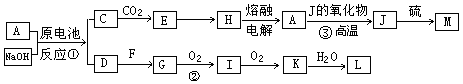
在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)。
回答下列问题:
(1)在反应②中,每生成2.24L气体G(标准状况)时,该反应转移电子的物质的量是___________mol。
(2)若反应①在加热条件下进行,单质A和化合物B按物质的量之比为1:2发生反应,且C、D是两种均能使澄清的石灰水变浑浊的无色气体,则反应①的化学方程式是___________________________________________。
(3)若反应①在溶液中进行,A是一元强碱,B是一种酸式盐,D是一种使湿润红色石蕊试纸变蓝的气体,且B遇盐酸能生成使品红溶液褪色的气体。在加热条件下,当A过量时,反应①的离子方程式是_________________________________________。
(1)0.2 molL(1分)
(2)2H2SO4(浓)+C 2SO2↑+CO2↑+2H2O(2分)
2SO2↑+CO2↑+2H2O(2分)
(3)HSO3-+NH4++2OH-=NH3↑+SO32-+2H2O(2分)
解析试题分析:由题中信息“E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体”,可知E为水,F为过氧化钠,G为氧气。2Na2O2+2H2O=4NaOH+O2↑. 每生成2.24L气体G(标准状况)时,转移的电子是2 mol. (2)图中反应①的信息知道,单质A是C和化合物B是浓硫酸,二者反应生成CO2和SO2,化学方程式2H2SO4(浓)+C 2SO2↑+CO2↑+2H2O; (3)图中信息:A是一元强碱,B是一种酸式盐,D是一种使湿润红色石蕊试纸变蓝的气体,且B遇盐酸能生成使品红溶液褪色的气体。A是NaOH,B是NH4HSO3.碱过量时 ①的离子方程式是HSO3-+NH4++2OH-=NH3↑+SO32-+2H2O
2SO2↑+CO2↑+2H2O; (3)图中信息:A是一元强碱,B是一种酸式盐,D是一种使湿润红色石蕊试纸变蓝的气体,且B遇盐酸能生成使品红溶液褪色的气体。A是NaOH,B是NH4HSO3.碱过量时 ①的离子方程式是HSO3-+NH4++2OH-=NH3↑+SO32-+2H2O
考点:框图推断题目,根据信息推断物质并书写方程式。铵盐和浓硫酸及SO2性质的考查。

向溶液X中持续通入过量气体Y,会产生“先浑浊,后澄清”现象的是
| A.X:氯化钙溶液 Y:二氧化碳 |
| B.X:硝酸钡溶液 Y:二氧化硫 |
| C.X:氯化铝溶液 Y:氨气 |
| D.X:偏铝酸钠溶液 Y:二氧化氮 |
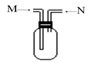

 (1)写出常温下单质X2与Z反应的离子方程式
(1)写出常温下单质X2与Z反应的离子方程式